Energie kann nicht erzeugt oder zerstört werden, aber sie kann in verschiedenen Formen gespeichert werden. Eine Möglichkeit, sie zu speichern, ist in Form von chemischer Energie in einer Batterie. Wenn sie in einem Stromkreis angeschlossen ist, kann eine Batterie Elektrizität erzeugen.
Eine Batterie hat zwei Enden – einen positiven Pol (Kathode) und einen negativen Pol (Anode). Wenn man die beiden Pole mit einem Draht verbindet, entsteht ein Stromkreis. Elektronen fließen durch den Draht und es wird ein elektrischer Strom erzeugt. Im Inneren der Batterie findet eine Reaktion zwischen Chemikalien statt. Die Reaktion findet aber nur statt, wenn ein Elektronenfluss vorhanden ist. Batterien können lange gelagert werden und funktionieren trotzdem, weil der chemische Prozess erst beginnt, wenn die Elektronen durch einen Stromkreis von den negativen zu den positiven Polen fließen.
Eine chemische Reaktion findet in einer Batterie statt
Ein einfaches Beispiel – die Zitronenzellenbatterie
Lassen Sie uns mit einer sehr einfachen Batterie beginnen, die eine Zitrone verwendet, in die zwei verschiedene metallische Objekte eingesetzt sind, zum Beispiel ein verzinkter Nagel und eine Kupfermünze oder ein Draht. Das Kupfer dient als positive Elektrode oder Kathode und der galvanisierte (verzinkte) Nagel als elektronenproduzierende negative Elektrode oder Anode. Diese beiden Objekte arbeiten als Elektroden und verursachen eine elektrochemische Reaktion, die eine kleine Potentialdifferenz erzeugt.
Da Kupfer (Cu)-Atome mehr Elektronen anziehen als Zink (Zn)-Atome, werden, wenn man ein Stück Kupfer und ein Stück Zink in Kontakt miteinander bringt, Elektronen vom Zink zum Kupfer wandern. Da sich die Elektronen auf dem Kupfer konzentrieren, stoßen sie sich gegenseitig ab und stoppen den Elektronenfluss vom Zink zum Kupfer. Legt man dagegen Streifen aus Zink und Kupfer in eine leitende Lösung und verbindet sie außen mit einem Draht, so werden die Reaktionen zwischen den Elektroden und der Lösung die Elektronen kontinuierlich durch den Draht fließen lassen.
|
LEMONENBATTERIE
|
Wie funktioniert eine Zitronenbatterie? Eine Zitronenbatterie besteht aus einer Zitrone und zwei metallischen Elektroden aus unterschiedlichen Metallen, wie z.B. einem Kupferpfennig oder Draht und einem verzinkten (verzinkten) Nagel. Die Energie für die Batterie kommt nicht von der Zitrone, sondern von der chemischen Veränderung im Zink (oder einem anderen Metall). Das Zink wird im Inneren der Zitrone oxidiert, tauscht einige seiner Elektronen aus, um einen niedrigeren Energiezustand zu erreichen, und die freigesetzte Energie liefert den Strom. Die Zitrone stellt lediglich eine Umgebung zur Verfügung, in der dies geschehen kann, aber sie wird bei diesem Prozess nicht verbraucht. Angenommen, es werden Zink- und Kupferelektroden verwendet (z. B. eine Kupfermünze und ein verzinkter Nagel), dann könnte eine einzelne Zitrone etwa 0,9 Volt erzeugen. Links zeigt eine Reihenschaltung von Zitronen, dass 3,41 Volt erzeugt werden. Hinweis: Kartoffeln, Äpfel, Sauerkraut oder jedes andere Obst oder Gemüse, das Säure oder einen anderen Elektrolyten enthält, können verwendet werden, aber Zitronen werden wegen ihres höheren Säuregehalts bevorzugt. In Kartoffeln ist der Elektrolyt z. B. Phosphorsäure, während er in Zitronen Zitronensäure ist. |
In einer Zitronenbatterie findet sowohl Oxidation (Verlust von Elektronen) als auch Reduktion (Gewinn von Elektronen) statt. Diese Batterie ähnelt den von Alessandro Volta erfundenen „einfachen voltaischen Zellen“ (siehe unten). An der Anode wird metallisches Zink oxidiert und geht als Zn2+-Ionen in die saure Lösung über:
Zn –> Zn2 + + 2 e-
An der Kupferkathode werden Wasserstoff-Ionen (gelöste Protonen aus der sauren Lösung in der Zitrone) zu molekularem Wasserstoff reduziert:
2H++ 2e- –> H2
Was bringt die Elektronen in Bewegung?
Wenn man einen Ball, den man in der Hand hält, loslässt, fällt er zu Boden, weil das Gravitationsfeld der Erde den Ball nach unten zieht. In ähnlicher Weise müssen geladene Teilchen wie Elektronen Arbeit verrichten, um sich von einem Punkt zum anderen zu bewegen. Der Betrag der Arbeit pro Ladungseinheit wird als elektrische Potentialdifferenz zwischen den beiden Punkten bezeichnet. Die Einheit der Potentialdifferenz heißt Volt.
Die Potentialdifferenz zwischen Kathode und Anode wird durch die chemische Reaktion aufgebaut. Im Inneren der Batterie werden die Elektronen durch die chemische Reaktion zum positiven Ende hin geschoben, wodurch eine Potentialdifferenz entsteht.
Es ist diese Potentialdifferenz, die die Elektronen durch den Draht treibt.
Die Potentialdifferenz kann positiv oder negativ sein, vergleichbar mit der Gravitationsenergie, die sich einen Hügel hinauf oder hinunter bewegt. In einer Batterie fließt der Elektronenfluss bergab… Elektronen können aber auch bergauf fließen, wie im Fall eines Batterieladegeräts.
Warum bewegen sich Elektronen innerhalb der Batterie nicht einfach von der Anode zur Kathode?
Der Elektrolyt in der Batterie verhindert, dass einzelne Elektronen direkt von der Anode zur Kathode innerhalb der Batterie wandern. Wenn die Pole mit einem leitenden Draht verbunden sind, können die Elektronen leicht von der Anode zur Kathode fließen.
In welche Richtung bewegen sich die Elektronen im Draht?
Elektronen sind negativ geladen, also werden sie vom positiven Ende einer Batterie angezogen und vom negativen Ende abgestoßen. Wenn die Batterie an ein Gerät angeschlossen ist, durch das die Elektronen fließen können, fließen sie vom negativen (Anode) zum positiven (Kathode) Pol.
Wer hat die elektrochemische Zelle (Batterie) erfunden?
|
VOLTAs ERSTE BATTERIE
|
Die von Volta hergestellte Batterie wird als die erste elektrochemische Zelle angesehen. Sie besteht aus zwei Elektroden: eine aus Zink, die andere aus Kupfer. Der Elektrolyt ist Schwefelsäure oder ein Solegemisch aus Salz und Wasser. Der Elektrolyt liegt in der Form 2H+ und SO42- vor. Das Zink, das in der elektrochemischen Reihe höher steht als sowohl Kupfer als auch Wasserstoff, reagiert mit dem negativ geladenen Sulfat SO42- . Die positiv geladenen Wasserstoffionen (Protonen) fangen Elektronen vom Kupfer ab und bilden Wasserstoffgasblasen, H2. Damit ist der Zinkstab die negative Elektrode und der Kupferstab die positive Elektrode. Wir haben nun zwei Anschlüsse, und der Strom fließt, wenn wir sie verbinden. Die Reaktionen in dieser Zelle sind wie folgt: Zink Zn –> Zn2+ + 2e- Schwefelsäure 2H+ + 2e- –> H2 Das Kupfer reagiert nicht und dient als Elektrode für die chemische Reaktion. |
Wie funktioniert eine moderne Batterie (Zink-Kohle-Batterie)?
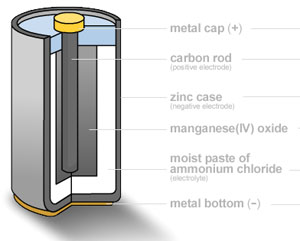 |
Eine Zink-Kohle-Trockenzelle oder -Batterie ist in einer Zinkdose verpackt, die sowohl als Behälter als auch als Minuspol (Anode) dient. Der Pluspol ist ein Kohlestab, der von einer Mischung aus Mangandioxid und Kohlepulver umgeben ist. Als Elektrolyt wird eine Paste aus Zinkchlorid und Ammoniumchlorid, gelöst in Wasser, verwendet. Der Kohlenstoffstab (Graphit) sammelt die Elektronen, die aus dem Anodenteil der Batterie kommen und zum Kathodenteil der Batterie zurückkehren. Kohlenstoff ist das einzige praktische Leitermaterial, da jedes herkömmliche Metall in der positiven Elektrode im salzhaltigen Elektrolyt schnell wegkorrodiert. Das Zink wird gemäß der folgenden Halbgleichung oxidiert. Das Mangandioxid wird mit Kohlenstoffpulver gemischt, um die elektrische Leitfähigkeit zu erhöhen. Die Reaktion läuft wie folgt ab: und die CL verbindet sich mit dem Zn2+. In dieser Halbreaktion wird das Mangan von der Oxidationsstufe (+4) auf (+3) reduziert. Es gibt noch weitere mögliche Nebenreaktionen, aber die Gesamtreaktion in einer Zink-Kohle-Zelle kann wie folgt dargestellt werden: Zn(s) + 2MnO2(s) + 2NH4Cl(aq) —> Mn2O3(s) + Zn(NH3)2Cl2 (aq) + H2O(l) Die Batterie hat einen e.m.f. von etwa 1,5 V. |
Welche Arten von Batterien gibt es?
Die verschiedenen Arten von Batterien verwenden verschiedene Arten von Chemikalien und chemischen Reaktionen. Einige der gebräuchlichsten Arten von Batterien sind:
|
Alkaline Batterie |
Wird in Duracell® und Energizer® und anderen Alkaline-Batterien verwendet. Die Elektroden bestehen aus Zink und Mangan-Oxid. Der Elektrolyt ist eine alkalische Paste. |
|
Blei-Säurebatterie |
Diese werden in Automobilen verwendet. Die Elektroden bestehen aus Blei und Bleioxyd mit einer starken Säure als Elektrolyt. |
|
Lithium-Batterie |
Diese Batterien werden in Kameras für die Blitzlampe verwendet. Sie werden mit Lithium, Lithium-Iodid und Blei-Iodid hergestellt. Sie können Stromstöße für den Blitz liefern. |
| Lithium-Batterie | Diese Batterien werden in Kameras für die Blitzlampe verwendet. Sie werden mit Lithium, Lithium-Iodid und Blei-Iodid hergestellt. Sie können Stromstöße für den Blitz liefern. |
| Lithium-Ionen-Akku | Diese Akkus findet man in Laptops, Handys und anderen tragbaren Geräten mit hohem Verbrauch. |
| Nickel-Cadmium- oder NiCad-Akku | Die Elektroden sind Nickel-Hydroxid und Cadmium. Der Elektrolyt ist Kaliumhydroxid. |
| Zink-Kohle-Batterie oder Standard-Kohle-Batterie – | Zink und Kohle werden in allen regulären oder Standard AA, C und D Trockenbatterien verwendet. Die Elektroden bestehen aus Zink und Kohlenstoff, wobei eine Paste aus säurehaltigen Materialien zwischen ihnen als Elektrolyt dient. |

