Gebräuchlicher Name: Östlicher Tigerschwalbenschwanz Wissenschaftlicher Name: Papilio (Pterourus) glaucus Linnaeus (Insecta: Lepidoptera: Papilionidae)
Der Östliche Tigerschwalbenschwanz Papilio glaucus Linnaeus ist wahrscheinlich unser bekanntester Schwalbenschwanz im Osten der USA. Er wird von Schmetterlingsgärtnern bewundert und von jungen Schmetterlingssammlern geschätzt. Die erste Zeichnung eines nordamerikanischen Schwalbenschwanzes war von einem männlichen Tigerschwalbenschwanz und wurde 1587 von John White gezeichnet, der Kommandant von Sir Walter Raleighs dritter Expedition nach Nordamerika war (Holland 1949, Opler und Krizek 1984). Die Popularität des Östlichen Tigerschwalbenschwanzes wird durch seine Verwendung auf zwei Briefmarken der Vereinigten Staaten deutlich (Abbildung 1).
Abbildung 1. US-Briefmarken mit östlichen Tigerschwalbenschwänzen, Papilio glaucus Linnaeus.
Nomenklatur (Back to Top)
Linnaeus gruppierte einige Schwalbenschwänze und andere Schmetterlinge unter dem Gattungsnamen Papilio (Tyler 1975). Papilio ist das lateinische Wort für Schmetterling. Der Untergattungsname Pterourus leitet sich von den griechischen Wurzeln „ptero“ für Flügel und „ura“ für Schwanz ab (Borror 1960).
Über die gattungsmäßige Einordnung der Schwalbenschwänze herrscht Uneinigkeit (Hancock 1983, Miller 1987). Einige Autoren (z. B. Tyler et al. 1994, Minno et al. 2005) folgen dem System, das die Untergattung Pterourus in den Gattungsstatus erhebt, wie es von Hancock (1983) vorgeschlagen wurde. Da der Name Papilio in den öffentlich zugänglichen Quellen immer noch so weit verbreitet ist, wird er hier aus praktischen Gründen anstelle von Pterourus verwendet.
Verbreitung (Back to Top)
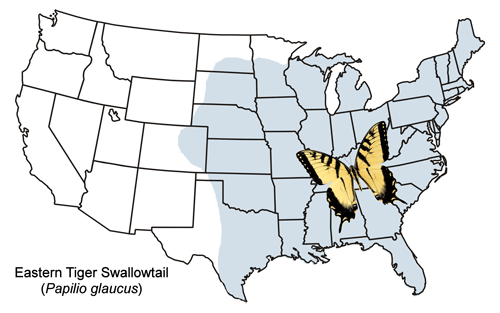
Der Östliche Tigerschwalbenschwanz ist von Neuengland westlich durch das Gebiet der südlichen Großen Seen und die meisten Staaten der Great Plains (mit einigen wenigen Nachweisen aus Colorado) und südlich bis Texas und Florida weit verbreitet (Abbildung 2). Im Norden der USA und im Süden Kanadas ist der Östliche Tigerschwalbenschwanz sympatrisch (innerhalb desselben geographischen Gebiets vorkommend) mit dem eng verwandten Kanadischen Tigerschwalbenschwanz, Papilio canadensis, der früher als Unterart von Papilio glaucus angesehen wurde (z. B. Emmel 1975, Scott 1986). Innerhalb dieser sympatrischen Zone kommen einige Hybriden vor (Hagen et al. 1991).
Abbildung 2. Verbreitungskarte von Papilio glaucus Linnaeus.
Beschreibung (Back to Top)
Erwachsene: Der Östliche Tigerschwalbenschwanz ist eine große Art mit einer Flügelspannweite von 7,9 bis 14,0 cm (ca. 3,12 bis 5,5 Zoll) (Pyle 1981). Erwachsene Tiere sind gelb mit vier schwarzen Bändern auf den Vorderflügeln (Abbildungen 3 und 4). Das innerste Band deckt sich mit dem Mittelband des Hinterflügels. Die Flügelränder sind schwarz mit einer Reihe gelber Flecken.
Abbildung 3. Adulter Tigerschwalbenschwanz, Papilio glaucus Linnaeus (Flügel gespreizt, zeigt die Rückenfläche). Foto von Donald W. Hall, University of Florida.
Abbildung 4. Adulter Tigerschwalbenschwanz, Papilio glaucus Linnaeus (Flügel gefaltet, zeigt die ventrale Oberfläche). Foto von Donald W. Hall, University of Florida.
Einige weibliche Tigerschwalbenschwänze sind dunkel gefärbt mit einer Randreihe aus gelben Flecken (Abbildung 5). Auf den Unterseiten der Vorderflügel der dunklen Form sind schwache Reste der typischen Tigerschwalbenschwanz-Streifen zu sehen (Abbildung 6). Die Hinterflügel der dunklen Form sind auf der Oberseite pudrig blau mit einem gewellten schwarzen Band, das die pudrig blauen Bereiche trennt. Dieses Band fehlt bei den weiblichen Würzbuschschwalbenschwänzen, Papilio troilus L., die ansonsten oberflächlich betrachtet den dunklen Tigerschwalbenschwänzen ähneln können. Außerdem sind die Randflecken von Papilio troilus typischerweise eher blaugrün als gelb.
Bei Schmetterlingen sind die Geschlechtschromosomen das Gegenteil von denen der Säugetiere. Weibliche Schmetterlinge sind das heterogame Geschlecht (XY), die Männchen sind homogametisch (XX). Gelbe Papilio glaucus-Weibchen gebären gelbe Weibchen, und dunkle Weibchen gebären dunkle Weibchen, was darauf hindeutet, dass das Gen für die Farbe auf dem Y-Chromosom liegt (Scriber et al.1995).
Abbildung 5. Dunkler weiblicher Tigerschwalbenschwanz, Papilio glaucus Linnaeus (Flügel gespreizt, zeigt die Rückenseite). Foto von Donald W. Hall, University of Florida.
Abbildung 6. Dunkler weiblicher Tigerschwalbenschwanz, Papilio glaucus Linnaeus (Flügel gefaltet, zeigt die Ventralseite mit charakteristischen Streifen). Foto von Donald W. Hall, University of Florida.
Die dunklen Weibchen gelten als Batesianische (essbare) Nachahmer des giftigen Rohrkolbenschwalbenschwanzes, Battus philenor (L.). (http://entnemdept.ufl.edu/creatures/bfly/pipevine_swallowtail.htm) (Brower 1958).
Eier: Die Eier sind grün (Minno und Minno 1999).
Larven: Ausgewachsene Larven erreichen eine Länge von bis zu 6,4 cm (ca. 2,5 Inch) (Minno et al. 2005). Die ersten drei Instanzen sind dunkelbraun mit einem weißen Sattel und ähneln Vogelkot (Minno und Minno 1999, Wagner 2005). Die Larven des vierten und fünften Instars sind grün mit einem geschwollenen Thorax und einem Querband aus schwachen blauen Punkten auf jedem Abdominalsegment (Abbildungen 7 und 8). Zwischen dem ersten und zweiten Abdominalsegment befindet sich ein schwarzer Querstreifen, der anterior gelb gesäumt ist und normalerweise in der Segmentfalte verborgen ist. Die Larven haben außerdem ein einzelnes Paar falscher Augenflecken auf dem Metathorax. Die Augenflecken sind gelb und schwarz umrandet und enthalten einen kleineren blauen Fleck, der schwarz umrandet ist, sowie eine schwarze Linie mesad (in Richtung der Mittellinie des Rückens) des blauen Flecks. Das Osmeterium ist orange (Minno et al. 2005). Larven im vierten Instadium behalten den weißen Sattel (Abbildung 7).
Abbildung 7. Larve des Tigerschwalbenschwanzes, Papilio glaucus Linnaeus, im vierten Instadium mit weißem Sattel. Foto von Donald W. Hall, University of Florida.
Abbildung 8. Larve des Tigerschwalbenschwanzes, Papilio glaucus Linnaeus, im letzten Larvenstadium. Foto von Jerry F. Butler, University of Florida.
Puppen: Die Puppen sind hellbraun mit einem dunkelbraunen oder schwarzen Seitenstreifen und einem braunen Dorsalband (Abbildung 9).
Abbildung 9. Puppe des Tigerschwalbenschwanzes, Papilio glaucus Linnaeus. Foto von Jerry F. Butler, University of Florida.
Lebenszyklus (Back to Top)
Im nördlichen Teil des Verbreitungsgebietes gibt es zwei Flüge und in Florida mindestens drei und möglicherweise vier Flüge (Scriber 1996). Der erste Flug in Florida beginnt Ende Februar oder Anfang März. Die erwachsenen Tiere suchen Nektar an einer Vielzahl von Blüten. Sie schlürfen auch Wasser und Mineralien aus Schlamm (Berger und Lederhouse 1985). Die Männchen patrouillieren oft in der Höhe der Baumkronen und stürzen sich in tiefere Ebenen, um die Weibchen zur Paarung abzufangen.
Eier werden einzeln und meist auf der Oberseite von Blättern abgelegt. Frisch geschlüpfte Larven fressen oft ihre Eihülle (Scriber 1996). Bei Lepidoptera-Eiern bleibt eine kleine Menge Dotter zwischen zwei der Embryonalmembranen (Amnion und Serosa) eingeschlossen, die nach dem Schlüpfen in den Eischalen verbleiben. Der restliche Dotter dient als erste Mahlzeit der Larve (Imms 1957). Dieses Verhalten kann auch die Entdeckung durch Räuber reduzieren (Lederhouse 1990), die durch die leere Eischale angelockt werden könnten.
Larven spinnen eine Seidenmatte auf einem Blatt, die bewirkt, dass sich die Blattränder nach oben rollen, aber sie produzieren keine vollständige Blattrolle. Die Larve ruht auf der Seidenmatte. Im mittleren bis späten Stadium bewegen sich die Larven von der Ruhestätte zu anderen Teilen der Pflanze, um zu fressen, und zurück zur Seidenmatte, um sich auszuruhen (Scriber 1996).
Abgekaute Blätter werden an den Blattstielen abgeschnitten und von der Pflanze abgeworfen, möglicherweise um die Anziehungskraft auf Parasitoide zu verringern, die von den flüchtigen Chemikalien angezogen werden, die von den abgekauten Blättern ausgehen, oder um die Prädation durch Vögel zu verringern, die ihre Beute durch die Suche nach beschädigten Blättern finden (Lederhouse 1990, Scriber 1996). Die Larven werfen ihren Frass (Kot) mit ihren Mandibeln. Dieses Verhalten kann auch die Entdeckung durch Räuber oder Parasitoide verringern (Lederhouse 1990, Scriber et al. 1995).
Nachdem die ausgewachsenen Larven die Nahrungsaufnahme eingestellt haben, nehmen sie eine grünlich-braune oder schokoladenbraune Färbung an und wandern an Baumstämmen hinunter und meist auf die Blattstreu, wo sie sehr kryptisch sind. Sie verpuppen sich oft auf der Unterseite von Zweigen oder toten Blättern am Boden (West und Hazel 1979). Die Puppe ist das Überwinterungsstadium (Minno et al. 2005).
Wirte (Back to Top)
Viele Arten von Bäumen und Sträuchern in mindestens sieben Familien werden als Wirte genutzt (Opler und Malikul 1998, Scott 1986). Auf der Halbinsel von Florida ist der süße Lorbeer (Magnolia virginiana ) der bevorzugte Wirt und scheint der einzige Wirt in der südlichen Hälfte der Halbinsel zu sein (Scriber 1986). Der Lorbeer wächst in feuchten Gebieten und kann von ähnlich aussehenden Persea-Arten (Lauraceae) durch die Stipularnarben, die den Zweig vollständig umgeben (Abbildung 10), und die glauköse (feine, wachsartige, weißliche Beschichtung) Unterseite der Blätter von Magnolia virginiana (Abbildung 11 ) unterschieden werden – Merkmale, die bei Persea-Arten fehlen. Darüber hinaus sind die Blüten, Früchte und Samen von Magnolia virginiana unverwechselbar (Abbildung 11).
Abbildung 10. Stämme von Magnolia virginiana (L.) (Magnoliaceae) mit Nebenblattnarben und dem ähnlich aussehenden roten Lorbeer, Persea borbonia, dem die Nebenblattnarben fehlen. Foto von Donald W. Hall, University of Florida.
Abbildung 11. Süßer Lorbeer, Magnolia virginiana (L.) (Magnoliaceae) mit charakteristischer glauköser Unterseite des Blattes (Inset a), der Blüte (Inset b) und des Samens (Pfeil). Foto von Donald W. Hall, University of Florida.
Tulpenbaum, Liriodendron tulipifera Linnaeus (Magnoliaceae) (Abbildung 12), Schwarzkirsche, Prunus serotina Ehrh. (Rosaceae) (Abbildung 13), Weißesche, Fraxinus americana Linnaeus (Oleaceae) (Abbildung 14), und Eberesche, Fraxinus caroliniana Mill. (Oleaceae), werden manchmal im nördlichen Florida verwendet (Minno und Minno 1999). Fotos von Fraxinus caroliniana finden Sie auf der Artenseite der Website Atlas of Florida Plants (Wunderlin et al. 2019). Eschen können von den sehr ähnlichen Hickorys (Carya-Arten) durch die entgegengesetzte Anordnung ihrer Blätter an den Stämmen im Vergleich zur wechselständigen Anordnung der Hickory-Blätter unterschieden werden.
Abbildung 12. Tulpenbaum, Liriodendron tulipifera L. (Magnoliaceae). Foto von Donald W. Hall, University of Florida.
Abbildung 13. Schwarzkirsche, Prunus serotina Ehrh., Laub und Blüten. Foto von Jerry F. Butler, University of Florida.
Abbildung 14. Weißesche, Fraxinus americana Linnaeus (Oleaceae). Foto von Donald W. Hall, University of Florida.
Ausgewählte Referenzen (Back to Top)
- Berger TA, Lederhouse RC. 1985. Puddling by single male and female tiger swallowtails, Papilio glaucus L. (Papilionidae). Journal of the Lepidopterists‘ Society 39: 339-340.
- Borror DJ. 1960. Dictionary of Word Roots and Combining Forms: Compiled from the Greek, Latin, and other Languages, with Special Reference to Biological and Scientific Names. Mayfield Publishing Company. Palo Alto, Kalifornien. 134 pp.
- Brower J. 1958. Experimentelle Studien zur Mimikry bei einigen nordamerikanischen Schmetterlingen: Part II. Battus philenor und Papilio troilus, P. polyxenes und P. glaucus. Evolution 12(2): 123-136.
- Emmel J. 1975. Subfamily Papilioninae. pp. 390-402. In: Howe WH. The Butterflies of North America. Doubleday & Company. Garden City, New York. 633 pp.
- Hagen RH, Lederhouse RC, Bossart JL, Scriber JM. 1991. Papilio canadensis und P. glaucus (Papilionidae) sind unterschiedliche Arten. Journal of the Lepidopterists‘ Society 45(4): 245-258.
- Hancock DL. 1983. Classification of the Papilionidae (Lepidoptera): A phylogenetic approach. Smithersia 2: 1-48.
- Holland WJ. 1949. The Butterfly Book. Doubleday & Company. Garden City, New York. 424 pp. + 77 Tafeln.
- Imms A.D. 1957. A General Textbook of Entomology: Including the Anatomy, Physiology, Development and Classification of Insects. p. 212. Neunte Auflage (vollständig überarbeitet von Richards OW, Davies RG). Methuen. London. 886 pp.
- Miller JS. 1987. Phylogenetische Studien bei den Papilioninae (Lepidoptera: Papilionidae). Bulletin of the American Museum of Natural History 186(4): 365-512.
- Minno M, Butler J, Hall D. 2005. Florida Butterfly Caterpillars and Their Host Plants. University Press of Florida. Gainesville, Florida. 341 pp.
- Minno MC, Minno M. 1999. Florida Butterfly Gardening. University Press of Florida. Gainesville, Florida. 210 pp.
- Lederhouse RC. 1990. Avoiding the hunt: Primary defenses of lepidopteran caterpillars. pp. 175-189. In Evans DL, Schmidt JO. (eds). Insect Defenses: Adaptive Mechanisms and Strategies of Prey and Predators. State University of New York Press. Albany, New York. 482 pp.
- Opler PA, Krizek GO. 1984. Butterflies East of the Great Plains. The Johns Hopkins University Press. Baltimore, Maryland.
- Opler PA, Malikul V. 1998. A Field Guide to Eastern Butterflies. Peterson Field Guides. Houghton Mifflin Company. New York, New York. 486 pp.
- Pyle RM. 1981. The Audubon Society Field Guide to North American Butterflies. Alfred A. Knopf. New York, New York. 916 pp.
- Scott JA. 1986. The Butterflies of North America. Stanford University Press. Stanford, CA.
- Scriber JM. 1986. Origins of the regional feeding abilities in the tiger swallowtail butterfly: ecological monophagy and the Papilio glaucus australis subspecies in Florida. Oecologia 71: 94-103.
- Scriber JM. 1996. Tiger tales: natural history of native North American swallowtails. American Entomologist 42: 19-32.
- Scriber JM, Tsubaki Y, Lederhouse RC, Eds. 1995. Swallowtail Butterflies: Their Ecology and Evolutionary Biology. Scientific Publishers. Gainesville, FL.
- Tyler HA. 1975. The Swallowtail Butterflies of North America. Naturegraph Publishers. Healdsburg, California. 192 pp.
- Tyler HA, Brown KS Jr, Wilson KH. 1994. Swallowtail Butterflies of the Americas. Scientific Publishers. Gainesville, Florida. 376 pp.
- West DA, Hazel WN. 1979. Natural pupation sites of swallowtail butterflies (Lepidoptera: Papilionidae): Papilio polyxenes Fabr., P. glaucus L. und Battus philenor (L.). Ecological Entomology 4: 387-392.
- Wagner DL. 2005. Caterpillars of Eastern North America. Princeton University Press. Princeton, New Jersey. 512 pp.
- Wunderlin RP, Hansen BF, Franck AR, Essig FB. 2019. Atlas of Florida Plants. Institute for Systematic Botany. University of South Florida. Tampa, Florida. (http://www.florida.plantatlas.usf.edu/) (Accessed March 19, 2020)