
J. J. Thomson levou a ciência a novas alturas com a sua descoberta do electrão em 1897 – a primeira partícula subatómica.
Ele também encontrou a primeira evidência de que elementos estáveis podem existir como isótopos e inventou uma das ferramentas mais poderosas da química analítica – o espectrómetro de massa.
Beginnings: Escola e Universidade
Joseph John Thomson nasceu a 18 de Dezembro de 1856 em Manchester, Inglaterra, Reino Unido.
p>O seu pai, Joseph James Thomson, dirigia uma livraria especializada que estava na sua família há três gerações. A sua mãe, Emma Swindells, veio de uma família que era proprietária de uma empresa de algodão.
Even quando jovem, Joey, que mais tarde seria conhecido como J. J., estava profundamente interessado na ciência. Aos 14 anos de idade tornou-se estudante no Owens College, a Universidade de Manchester, onde estudou matemática, física e engenharia.
Um rapaz tímido, os seus pais esperavam que ele se tornasse um aprendiz de engenheiro com uma companhia de locomotivas. Estas esperanças foram frustradas com a morte do seu pai quando J. J. tinha 16 anos. Os honorários dos aprendizes de engenharia eram elevados, e a sua mãe não os podia pagar.
Esta infelicidade acabou por beneficiar a ciência porque J. J. precisava de encontrar financiamento para continuar a sua educação. Em 1876, com 19 anos, ganhou esse financiamento, não em engenharia, mas em matemática, na Universidade de Cambridge. Quatro anos mais tarde licenciou-se com altas honras.
Thomson continuou a estudar em Cambridge e em 1882 ganhou o Prémio Adam, um dos prémios de matemática mais procurados da universidade. Em 1883, obteve o grau de mestre em matemática.
Trabalho de Investigação Inicial
Atoms
Quando Thomson começou a trabalhar como estudante de investigação ninguém tinha uma imagem clara de como os átomos poderiam parecer. Thomson decidiu que os visualizaria como um anel de fumo e ver onde a matemática que descreve tal fotografia o levou. Este trabalho, pelo qual lhe foi atribuído tanto o Prémio de Adão como o seu mestrado, tinha o título de A Treatise on the Motion of Vortex Rings. Embora o título e os capítulos iniciais pudessem sugerir que a matemática aplicada era o tema principal, os títulos das secções finais são reveladores:
- Pressão de um gás. Lei de Boyle
li>Efusão térmicali>Esboço de uma teoria químicali>Teoria da quantivalênciali>Valência dos vários elementos
Thomson estava a empurrar a sua poderosa mente matemática para uma compreensão mais profunda da matéria.
Electricidade e Magnetismo
Além dos átomos, Thomson começou a interessar-se seriamente pelas equações de James Clerk Maxwell, que tinham revelado a electricidade e o magnetismo como manifestações de uma única força – a força electromagnética – e tinham revelado que a luz era uma onda electromagnética.
Em 1893, aos 36 anos de idade, Thomson publicou Notes on Recent Researches in Electricity and Magnetism, com base no trabalho de Maxwell. O seu livro é por vezes descrito como “Maxwell’s Equations Volume 3”
 “Atrevo-me a dar um método alternativo de considerar os processos que ocorrem no campo eléctrico, que muitas vezes considerei útil e que é, de um ponto de vista matemático, equivalente à Teoria de Maxwell”
“Atrevo-me a dar um método alternativo de considerar os processos que ocorrem no campo eléctrico, que muitas vezes considerei útil e que é, de um ponto de vista matemático, equivalente à Teoria de Maxwell”
As Contribuições Mais Significativas de Thomson para a Ciência
Descoberta do Electrão – A primeira partícula subatómica
Em 1834, Michael Faraday cunhou a palavra ion para descrever partículas carregadas que eram atraídas por eléctrodos carregados positiva ou negativamente. Assim, no tempo de Thomson, já se sabia que os átomos estão de alguma forma associados a cargas eléctricas, e que os átomos podiam existir em formas iónicas, transportando cargas positivas ou negativas. Por exemplo, o sal de mesa é feito de átomos de sódio e cloro ionizados.
Na+: Um íon de sódio com uma única carga positiva
Cl-: Um ião cloreto com uma única carga negativa
Em 1891, George Johnstone Stoney cunhou a palavra electrão para representar a unidade fundamental de carga eléctrica. Ele não propôs, contudo, que o electrão existisse como uma partícula por direito próprio. Ele acreditava que representava a menor unidade de carga que um átomo ionizado poderia ter.
Atoms ainda eram considerados indivisíveis.
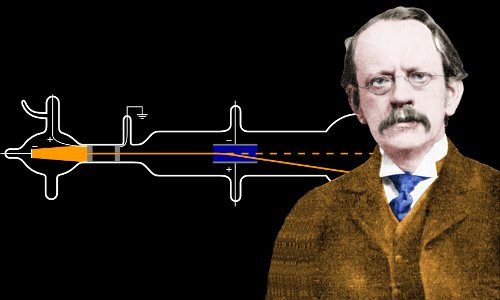
Em 1897, aos 40 anos de idade, Thomson realizou uma experiência agora famosa com um tubo de raios catódicos.
 p>A cathode ray tube, semelhante ao utilizado por J. J. Thomson. O ar no tubo de vidro oco é bombeado para fora para criar um vácuo. Os electrões são produzidos no cátodo por uma alta voltagem e viajam através do vácuo, criando um brilho verde quando atingem o vidro na extremidade. Aqui uma cruz de metal funde uma sombra, estabelecendo que os electrões viajam em linhas rectas e não podem viajar através do metal. Imagem de Zátonyi Sándor.
p>A cathode ray tube, semelhante ao utilizado por J. J. Thomson. O ar no tubo de vidro oco é bombeado para fora para criar um vácuo. Os electrões são produzidos no cátodo por uma alta voltagem e viajam através do vácuo, criando um brilho verde quando atingem o vidro na extremidade. Aqui uma cruz de metal funde uma sombra, estabelecendo que os electrões viajam em linhas rectas e não podem viajar através do metal. Imagem de Zátonyi Sándor. Quando Thomson permitiu que os seus raios catódicos viajassem através do ar em vez do habitual vácuo, ficou surpreendido com a distância que podiam percorrer antes de serem parados. Isto sugeriu-lhe que as partículas dentro dos raios catódicos eram muitas vezes menores do que os cientistas tinham estimado que os átomos seriam.
Então, as partículas dos raios catódicos eram mais pequenas do que os átomos! E a sua massa? Será que tinham uma massa típica de, digamos, um átomo de hidrogénio? – a menor partícula então conhecida.
Para estimar a massa de uma partícula de raio catódico e descobrir se a sua carga era positiva ou negativa, Thomson deflectiu raios catódicos com campos eléctricos e magnéticos para ver a direcção em que foram deflectidos e até onde foram puxados para fora do curso. Ele sabia que o tamanho da deflexão lhe diria sobre a massa da partícula e a direcção da deflexão lhe diria a carga que as partículas levavam. Ele também estimou a massa medindo a quantidade de calor gerada pelas partículas quando atingissem um alvo.
Thomson utilizou uma câmara de nuvem para estabelecer que uma partícula de raio catódico transporta a mesma quantidade de carga (isto é, uma unidade) que um ião de hidrogénio.
Destas experiências ele tirou três conclusões revolucionárias:
- As partículas de raio catódico são carregadas negativamente.
- As partículas de raios catódicos são pelo menos mil vezes mais leves do que um átomo de hidrogénio.
- Sejam quais forem as fontes utilizadas para as gerar, todas as partículas de raios catódicos são de massa e carga idênticas.
2,300 anos antes, na Grécia Antiga, Demócrito tinha utilizado o seu intelecto para deduzir a existência de átomos.
Em 1808, John Dalton tinha ressuscitado a ideia de Demócrito com a sua teoria atómica.
Pelo tempo de Thomson, os cientistas estavam convencidos de que os átomos eram as partículas mais pequenas do universo, os blocos fundamentais de construção de tudo.
Estas crenças foram quebradas pelas experiências de J. J. Thomson, que provaram a existência de uma nova partícula fundamental, muito menor do que o átomo: o electrão. O mundo nunca mais voltaria a ser o mesmo.
Físicos tinham agora um incentivo para investigar partículas subatómicas – partículas mais pequenas do que o átomo. Desde então, têm feito isto, tentando descobrir os blocos de construção que constituem os blocos de construção que constituem os blocos de construção que constituem os blocos de construção… da matéria.
Embora muitos blocos de construção tenham sido descobertos, o electrão de Thomson parece ser uma partícula verdadeiramente fundamental que não pode ser mais dividida.
Thomson recebeu o Prémio Nobel da Física de 1906 pela sua descoberta.

J. J. Thomson no seu laboratório operando um tubo de raios catódicos. Embora um teórico brilhante, um brilhante desenhador de experiências, e um brilhante intérprete de resultados experimentais, Thomson foi notoriamente martelado com aparelhos de laboratório!
 “Como os raios catódicos transportam uma carga de electricidade negativa, são desviados por uma força electrostática como se fossem electrificados negativamente, e são actuados por uma força magnética exactamente da forma como esta força actuaria num corpo electrificado negativamente em movimento ao longo da trajectória destes raios, não vejo como escapar à conclusão de que são cargas de electricidade negativa transportadas por partículas de matéria”
“Como os raios catódicos transportam uma carga de electricidade negativa, são desviados por uma força electrostática como se fossem electrificados negativamente, e são actuados por uma força magnética exactamente da forma como esta força actuaria num corpo electrificado negativamente em movimento ao longo da trajectória destes raios, não vejo como escapar à conclusão de que são cargas de electricidade negativa transportadas por partículas de matéria”
O Átomo como um Pudim de Ameixa
Com base nos seus resultados, Thomson produziu o seu famoso (mas incorrecto) modelo de pudim de ameixa do átomo. Ele imaginou o átomo como um “pudim” com carga positiva uniforme dentro do qual as ameixas (electrões) orbitavam.
Invenção do Espectrómetro de Massa
Ao descobrir o electrão, Thomson avançou também para a invenção de uma nova ferramenta imensamente importante para a análise química – o espectrómetro de massa.
Na sua forma mais simples, um espectrómetro de massa assemelha-se a um tubo de raios catódicos, mas o seu feixe de partículas carregadas é constituído por iões positivos e não por electrões. Estes iões são desviados de uma trajectória em linha recta por campos eléctricos/magnéticos. A quantidade de deflexão depende da massa do ião (as massas baixas são mais deflectidas) e da carga (as cargas altas são mais deflectidas).
Por meio de materiais ionizantes e passando-os por um espectrómetro de massa, os elementos químicos presentes no material podem ser deduzidos pela medida em que os seus iões são deflectidos.
Cada átomo de hidrogénio tem apenas um electrão
Em 1907, Thomson estabeleceu, utilizando uma variedade de métodos, que cada átomo de hidrogénio tem apenas um electrão.
Descoberta de Isótopos de Elementos Estáveis
Embora Thomson tivesse descoberto o electrão, os cientistas ainda tinham um longo caminho a percorrer para alcançar mesmo uma compreensão básica do átomo: os prótons e os neutrões ainda não tinham sido descobertos.
Embora estes obstáculos, em 1912 Thomson descobriu que os elementos estáveis podiam existir como isótopos. Por outras palavras, o mesmo elemento poderia existir com massas atómicas diferentes.
Thomson fez esta descoberta quando o seu estudante de investigação Francis Aston disparou néon ionizado através de um campo magnético e eléctrico – isto é, utilizou um espectrómetro de massa – e observou duas deflexões distintas. Thomson concluiu que o néon existe em duas formas cujas massas são diferentes – ou seja, isótopos.
Aston ganhou o Prémio Nobel da Química de 1922 por continuar este trabalho, descobrindo um grande número de isótopos estáveis e descobrindo que todas as massas isotópicas são múltiplos em número inteiro da massa do átomo de hidrogénio.
alguns detalhes pessoais e o fim
Em 1890, 33 anos, Thomson casou com Rose Elizabeth Paget, uma jovem física a trabalhar no seu laboratório. Ela era filha de um professor de medicina de Cambridge. O casal tinha um filho, George, e uma filha, Joan.
Humble e modesto, com um sentido de humor tranquilo, são provavelmente as melhores palavras para resumir a personalidade de Thomson.
Apesar da sua modéstia, aos 27 anos de idade tornou-se Professor Cavendish de Física Experimental em Cambridge – um papel desempenhado pela primeira vez por James Clerk Maxwell. No seu papel como Professor Cavendish, sentava-se frequentemente a fazer cálculos na própria cadeira que o próprio Maxwell ocupara em tempos.
Além de fazer ele próprio descobertas notáveis, Thomson preparou o caminho para a grandeza para um número significativo de outros cientistas. Um número notável de investigadores de Thomson ganhou prémios Nobel, incluindo Charles T. R. Wilson, Charles Barkla, Ernest Rutherford, Francis Aston, Owen Richardson, William Henry Bragg, William Lawrence Bragg, e Max Born.
Thomson tinha 40 anos quando Ernest Rutherford chegou ao seu laboratório. Após a reunião, Rutherford escreveu de Thomson:
“Ele é muito agradável na conversa e não é de todo fossilizado. Quanto à aparência, é um homem de tamanho médio, ainda escuro e bastante jovem: barbeia-se, muito mal, e usa o cabelo bastante comprido”
31 anos depois de Thomson ter recebido o Prémio Nobel que o seu filho George lhe atribuiu. O prémio de George de 1937 foi também para o trabalho com electrões, que ele provou poder comportar-se como ondas.
 “É um facto fascinante que pai e filho deram as provas mais marcantes das propriedades aparentemente contraditórias do electrão: o pai a provar o seu carácter como partícula, o filho o seu carácter como onda… Thomson estava extremamente orgulhoso do sucesso do seu filho e tentou assimilar os novos resultados nas suas velhas convicções.”
“É um facto fascinante que pai e filho deram as provas mais marcantes das propriedades aparentemente contraditórias do electrão: o pai a provar o seu carácter como partícula, o filho o seu carácter como onda… Thomson estava extremamente orgulhoso do sucesso do seu filho e tentou assimilar os novos resultados nas suas velhas convicções.”
Thomson foi nomeado cavaleiro em 1908, tornando-se Sir J. J. Thomson.
A jardinagem era o seu hobby.
J. J. Thomson morreu aos 83 anos de idade, a 30 de Agosto de 1940. As suas cinzas foram enterradas na Nave da Abadia de Westminster, juntando-se a outros grandes cientistas como Isaac Newton, Lord Kelvin, Charles Darwin, Charles Lyell, e o seu amigo e antigo investigador Ernest Rutherford.
>/div>
Autor desta página: O Doc
Imagens de cientistas nesta página melhoradas digitalmente e coloridas por este sítio web. © Todos os direitos reservados.
Cite esta página
Por favor use a seguinte citação compatível com MLA:
"J. J. Thomson." Famous Scientists. famousscientists.org. 27 Jul. 2015. Web. <www.famousscientists.org/j-j-thomson/>.
Publicado por FamousScientists.org
Outras Leituras
J. J. Thomson
Um tratado sobre o movimento dos anéis de vórtice
MacMillan and Co. Londres, 1883
J. J. Thomson
Notas sobre Pesquisas Recentes em Electricidade e Magnetismo
Clarendon Press, 1893
J. J. Thomson
Em corpos mais pequenos que átomos
Prensa de Ciência Popular, Agosto, 1901
J. J. Thomson
Número de Corpúsculos num Átomo
Revista Filosófica, vol. 11, Junho de 1906. p. 769-781
p>Nascido Máximo
Notificação de Opúsculos de Sir J. J. Thomson
Proceedings of the Physical Society, 53 iii, 1942.p>Abraham Pais
Niels Bohr’s Times: Em Physics, Philosophy, and Polity
Clarendon Press, 1993 p>Creative Commons Images
Cathode Ray Tube by Zátonyi Sándor, Creative Commons Attribution-Share Alike 3.0 Unported.