Em termos simplistas, os anticorpos desempenham duas funções principais em diferentes regiões da sua estrutura. Enquanto uma parte do anticorpo, o fragmento de ligação ao antigénio (Fab), reconhece o antigénio, a outra parte do anticorpo, conhecida como o fragmento cristalizável (Fc), interage com outros elementos do sistema imunitário, tais como fagócitos ou componentes da via do complemento, para promover a remoção do antigénio.
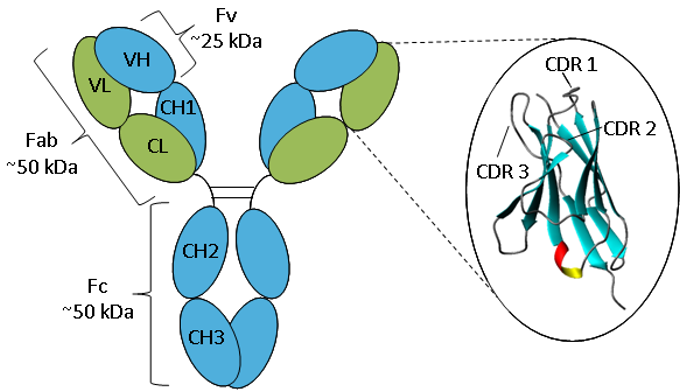 p>Figure. Representação esquemática de um anticorpo IgG.
p>Figure. Representação esquemática de um anticorpo IgG.Um anticorpo consiste em duas cadeias pesadas (azul) e duas cadeias leves (verde) dobradas em domínios constantes e variáveis. A ampliação do domínio variável mostra uma representação em fita da estrutura da folha β e loops CDR.
Anticorpos todos têm a mesma estrutura básica que consiste em duas cadeias pesadas e duas cadeias leves formando dois braços Fab contendo domínios idênticos em ambas as extremidades ligados por uma região de dobradiça flexível à haste do anticorpo, o domínio Fc, dando a forma clássica de ‘Y’. As cadeias dobram-se em dobras repetidas de imunoglobulina que consistem em folhas antiparalelas β (1), que formam domínios constantes ou variáveis. Os domínios Fab consistem em dois domínios variáveis e dois domínios constantes, sendo que os dois domínios variáveis constituem o fragmento variável (Fv), que fornece a especificidade antigénica do anticorpo (2) com os domínios constantes actuando como um quadro estrutural. Cada domínio variável contém três loops hipervariáveis, conhecidos como regiões determinantes da complementaridade (CDRs), distribuídos uniformemente entre quatro regiões de estrutura menos variável (FR). São os CDRs que fornecem um sítio específico de reconhecimento de antigénios na superfície do anticorpo e a hipervariabilidade destas regiões permite que os anticorpos reconheçam um número quase ilimitado de antigénios (3).
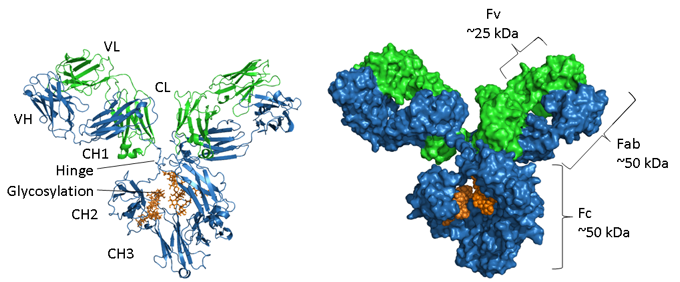
Figure. Representações estruturais de uma IgG.
A cadeia pesada é mostrada em azul, cadeia leve em verde e glicosilação em laranja. À esquerda está uma representação de fitas mostrando os elementos estruturais secundários e do lado direito está um modelo cheio de espaço da mesma molécula. O número de adesão PDB do rato IgG1 é 1IGY.
Os anticorpos são proteínas glicosiladas, com a posição e extensão da glicosilação variando entre isótipos. Como se mostra na imagem acima, a região Fc de um IgG consiste em dois domínios CH3 emparelhados e, em contraste, dois domínios CH2 que estão separados e não interagem mas têm duas cadeias de oligossacarídeos interpostos entre eles. Estas cadeias cobrem as faces hidrofóbicas que normalmente levariam ao emparelhamento de domínios. Os N-glycans contêm uma região central comum de dois resíduos de N-acetil-glucosamina (GlcNAc) ligados a uma asparagina (N297 em IgG1 humano) através de uma ligação amida e três resíduos de manose. Esta estrutura do núcleo pode conter açúcares terminais adicionais, tais como manose, GlcNac, galactose, fucose e ácido siálico, gerando uma grande quantidade de heterogeneidade (4).
<< Uma breve história de anticorpos Isótipos de anticorpos & subtipos >>
<< Visão geral dos anticorpos >>
- Poljak, R.J., Amzel, L.M., Avey, H.P., Chen, B.L., Phizackerley, R.P., e Saul, F. (1973). Estrutura tridimensional do fragmento de Fab’ de uma imunoglobulina humana com resolução 2,8-A. Proc. Natl. Acad. Sci. U.S.A. 70, 3305-3310.
- Wright, A., e Morrison, S.L. (1998). Efeito da estrutura de carboidratos associados ao C2 na função do efeito Ig: estudos com anticorpos quiméricos de IgG1 de rato-humano em mutantes de glicosilação de células de ovários de hamsters chineses. J. Imunol. 160, 3393-3402.
Inbar, D., Hochman, J., e Givol, D. (1972). Localização de locais de combate a anticorpos dentro das porções variáveis de cadeias pesadas e ligeiras. Proc. Natl. Acad. Sci. U.S.A. 69, 2659-2662.li>Morea, V., Lesk, A.M., e Tramontano, A. (2000). Antibody modeling: implicações para a engenharia e design. Métodos 20, 267-279.