Resultados de Aprendizagem
- li>Identificar tipos de receptores, a sua composição molecular, e as diferenças entre eles
Receptores são moléculas proteicas na célula alvo ou na sua superfície que ligam o ligante. Existem dois tipos de receptores, receptores internos e receptores de superfície celular.
Receptores internos

Figure 1. As moléculas de sinalização hidrofóbica difundem-se tipicamente através da membrana plasmática e interagem com os receptores intracelulares no citoplasma. Muitos receptores intracelulares são factores de transcrição que interagem com o ADN no núcleo e regulam a expressão genética.
Receptores internos, também conhecidos como receptores intracelulares ou citoplasmáticos, encontram-se no citoplasma da célula e respondem a moléculas de ligante hidrofóbico que são capazes de viajar através da membrana plasmática. Uma vez dentro da célula, muitas destas moléculas ligam-se a proteínas que actuam como reguladoras da síntese do mRNA (transcrição) para mediar a expressão genética. A expressão génica é o processo celular de transformar a informação no ADN de uma célula numa sequência de aminoácidos, que acaba por formar uma proteína. Quando o ligante se liga ao receptor interno, é desencadeada uma mudança conformacional que expõe um local de ligação do ADN à proteína. O complexo ligante-receptor move-se para o núcleo, liga-se então a regiões reguladoras específicas do ADN cromossómico e promove o início da transcrição (Figura 1). A transcrição é o processo de copiar a informação no ADN de uma célula numa forma especial de RNA chamado RNA mensageiro (mRNA); a célula utiliza a informação no mRNA (que se desloca para o citoplasma e se associa com ribossomas) para ligar aminoácidos específicos na ordem correcta, produzindo uma proteína. Os receptores internos podem influenciar directamente a expressão genética sem ter de passar o sinal para outros receptores ou mensageiros.
Receptores de superfície celular
Receptores de superfície celular, também conhecidos como receptores transmembrana, são proteínas de superfície celular, ancoradas na membrana (integral) que se ligam a moléculas ligandas externas. Este tipo de receptor atravessa a membrana plasmática e realiza a transdução de sinal, na qual um sinal extracelular é convertido num sinal intercelular. Os ligandos que interagem com os receptores de superfície celular não têm de entrar na célula que afectam. Os receptores de superfície celular são também chamados de proteínas ou marcadores específicos da célula porque são específicos de cada tipo de célula.
Cada receptor de superfície celular tem três componentes principais: um domínio ligante externo, uma região hidrofóbica de membrana, e um domínio intracelular dentro da célula. O domínio ligante-ligante é também chamado de domínio extracelular. A dimensão e extensão de cada um destes domínios varia muito, dependendo do tipo de receptor.
Porque as proteínas receptoras da superfície celular são fundamentais para o funcionamento normal da célula, não deve ser surpresa que um mau funcionamento em qualquer uma destas proteínas possa ter consequências graves. Os erros nas estruturas proteicas de certas moléculas receptoras têm demonstrado desempenhar um papel na hipertensão (tensão alta), asma, doença cardíaca e cancro.
Como os vírus reconhecem um hospedeiro
Células vivas não semelhantes, muitos vírus não têm uma membrana plasmática ou qualquer uma das estruturas necessárias para sustentar a vida. Alguns vírus são simplesmente compostos por uma casca de proteína inerte contendo ADN ou RNA. Para se reproduzirem, os vírus devem invadir uma célula viva, que serve de hospedeiro, e depois tomar conta do aparelho celular do hospedeiro. Mas como é que um vírus reconhece o seu hospedeiro?
Vírus ligam-se frequentemente a receptores de superfície celular na célula hospedeira. Por exemplo, o vírus que causa a gripe humana (gripe) liga-se especificamente aos receptores nas membranas das células do sistema respiratório. As diferenças químicas nos receptores da superfície celular entre os hospedeiros significam que um vírus que infecta uma espécie específica (por exemplo, humanos) não pode infectar outra espécie (por exemplo, galinhas).
No entanto, os vírus têm quantidades muito pequenas de ADN ou ARN em comparação com os humanos, e, como resultado, a reprodução viral pode ocorrer rapidamente. A reprodução viral produz invariavelmente erros que podem levar a alterações nos vírus recentemente produzidos; estas alterações significam que as proteínas virais que interagem com os receptores da superfície celular podem evoluir de tal forma que se podem ligar aos receptores num novo hospedeiro. Tais alterações ocorrem aleatoriamente e com bastante frequência no ciclo reprodutivo de um vírus, mas as alterações só têm importância se um vírus com novas propriedades de ligação entrar em contacto com um hospedeiro adequado. No caso da gripe, esta situação pode ocorrer em locais onde animais e pessoas estão em contacto próximo, tais como explorações de aves de capoeira e suínos. Assim que um vírus salta para um novo hospedeiro, pode propagar-se rapidamente. Os cientistas observam de perto os novos vírus (chamados vírus emergentes) na esperança de que tal monitorização possa reduzir a probabilidade de epidemias virais globais.
Receptores de superfície celular estão envolvidos na maior parte da sinalização em organismos multicelulares. Existem três categorias gerais de receptores de superfície celular: receptores ligados ao canal iónico, receptores ligados à proteína G, e receptores ligados à enzima.

Figure 2. Os canais de iões fechados formam um poro através da membrana de plasma que se abre quando a molécula de sinalização se liga. O poro aberto permite então que os iões entrem ou saiam da célula.
receptores ligados aos canais de iões ligam um ligando e abrem um canal através da membrana que permite a passagem de iões específicos. Para formar um canal, este tipo de receptor de superfície celular tem uma extensa região de membranas. A fim de interagir com as caudas de ácido gordo fosfolípido que formam o centro da membrana plasmática, muitos dos aminoácidos na região de dispersão da membrana são de natureza hidrófoba. Por outro lado, os aminoácidos que revestem o interior do canal são hidrofílicos para permitir a passagem de água ou iões. Quando um ligando se liga à região extracelular do canal, há uma alteração conformacional na estrutura das proteínas que permite a passagem de iões como o sódio, cálcio, magnésio e hidrogénio (Figura 2).
receptores ligados à proteína G ligam um ligando e activam uma proteína de membrana chamada proteína G. A proteína G activada interage então com um canal iónico ou uma enzima na membrana (Figura 3). Todos os receptores ligados à proteína G têm sete domínios transmembrana, mas cada receptor tem o seu próprio domínio extracelular específico e sítio de ligação à proteína G.
A sinalização de célula usando receptores ligados à proteína G ocorre como uma série cíclica de eventos. Antes do ligante ligar, a proteína G inactiva pode ligar-se a um sítio recentemente revelado no receptor específico para a sua ligação. Assim que a proteína G se liga ao receptor, a mudança de forma resultante activa a proteína G, que liberta o PIB e pega no GTP. As subunidades da proteína G dividem-se então na subunidade α e na subunidade βγ. Um ou ambos estes fragmentos de proteína G podem ser capazes de activar outras proteínas como resultado. Após algum tempo, o GTP na subunidade activa α da proteína G é hidrolisado ao PIB e a subunidade βγ é desactivada. As subunidades reassociam-se para formar a proteína G inactiva e o ciclo começa de novo.
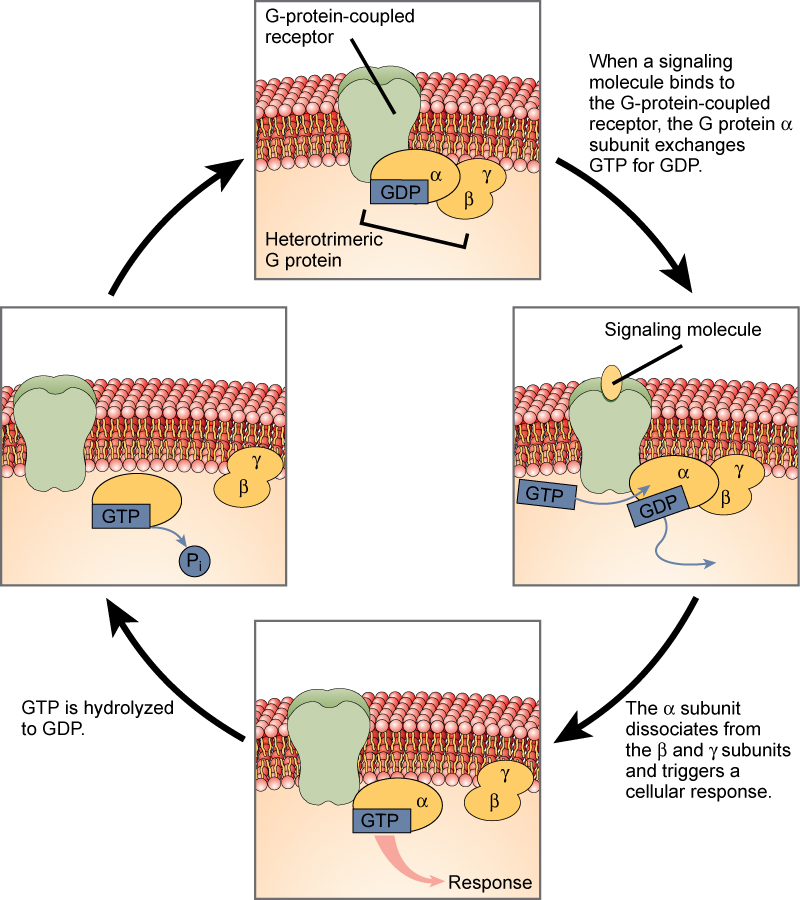
Figure 3. As proteínas Heterotriméricas G têm três subunidades: α, β, e γ. Quando uma molécula de sinalização se liga a um receptor acoplado à proteína G na membrana plasmática, uma molécula GDP associada à subunidade α é trocada por GTP. As subunidades β e γ dissociam-se da subunidade α, e uma resposta celular é desencadeada ou pela subunidade α ou pelo par βγ dissociado. A hidrólise de GTP para GDP termina o sinal.
receptores ligados à proteína G foram extensivamente estudados e muito se aprendeu sobre os seus papéis na manutenção da saúde. As bactérias que são patogénicas para os humanos podem libertar venenos que interrompem a função específica dos receptores ligados à proteína G, levando a doenças como a tosse convulsa, botulismo, e cólera.

Figure 4. Transmitida principalmente através de água potável contaminada, a cólera é uma das principais causas de morte no mundo em desenvolvimento e em áreas onde as catástrofes naturais interrompem a disponibilidade de água limpa. (crédito: New York City Sanitary Commission)
Na cólera (Figura 4), por exemplo, a bactéria da água Vibrio cholerae produz uma toxina, o coleragénio, que se liga às células que revestem o intestino delgado. A toxina entra então nestas células intestinais, onde modifica uma proteína G que controla a abertura de um canal de cloreto e a faz permanecer continuamente activa, resultando em grandes perdas de fluidos do corpo e desidratação potencialmente fatal como resultado.
Sanitário moderno elimina a ameaça de surtos de cólera, como o que varreu a cidade de Nova Iorque em 1866. Este poster daquela época mostra como, naquela época, a forma como a doença era transmitida não era compreendida.
Receptores ligados à enzima são receptores à superfície celular com domínios intracelulares que estão associados a uma enzima. Em alguns casos, o domínio intracelular do próprio receptor é uma enzima. Outros receptores ligados a enzimas têm um pequeno domínio intracelular que interage directamente com uma enzima. Os receptores ligados à enzima têm normalmente grandes domínios extracelulares e intracelulares, mas a região de membrana consiste numa única região alfa-helical do cordão de peptídeo. Quando um ligante se liga ao domínio extracelular, um sinal é transferido através da membrana, activando a enzima. A activação da enzima desencadeia uma cadeia de eventos dentro da célula que eventualmente leva a uma resposta. Um exemplo deste tipo de receptor ligado à enzima é o receptor de tirosina quinase (Figura 5). Uma quinase é uma enzima que transfere grupos de fosfato de ATP para outra proteína. O receptor de tirosina quinase transfere grupos de fosfato para moléculas de tirosina (resíduos de tirosina). Primeiro, as moléculas sinalizadoras ligam-se ao domínio extracelular de dois receptores de tirosina quinase próximos. Os dois receptores vizinhos ligam-se então, ou dimerizam. Os fosfatos são então adicionados aos resíduos de tirosina no domínio intracelular dos receptores (fosforilação). Os resíduos fosforilados podem então transmitir o sinal ao mensageiro seguinte dentro do citoplasma.
Practice Question

Figure 5. Um receptor tirosina quinase é um receptor ligado a uma enzima com uma única região transmembrana, e domínios extracelulares e intracelulares. A ligação de uma molécula de sinalização ao domínio extracelular faz com que o receptor diminua a sua intensidade. Os resíduos de tirosina no domínio intracelular são então auto-fosforados, desencadeando uma resposta celular a jusante. O sinal é terminado por uma fosfátase que remove os fosfatos dos resíduos de fosfotirosina.
HER2 é uma tirosina quinase receptora. Em 30% dos cancros mamários humanos, HER2 é permanentemente activado, resultando numa divisão celular não regulada. O Lapatinib, um medicamento utilizado para tratar o cancro da mama, inibe a auto-fosforilação do receptor de HER2 tirosina quinase (o processo pelo qual o receptor adiciona fosfatos a si próprio), reduzindo assim o crescimento tumoral em 50 por cento. Além da autofosforilação, qual das seguintes etapas seria inibida por Lapatinib?
- Li>Ligação da molécula de sinalização, dimerização, e a resposta celular a jusante
- Dimerização, e a resposta celular a jusante
- A resposta celular a jusante
- Atividade da fosfatase, dimerização, e a resposta celular a jusante
Try It
br>>/p>>/div>
Contributo!
Melhorar esta páginaAprenda Mais