Estas são notas da palestra 11 do curso de Biologia Celular de Harvard Extension.
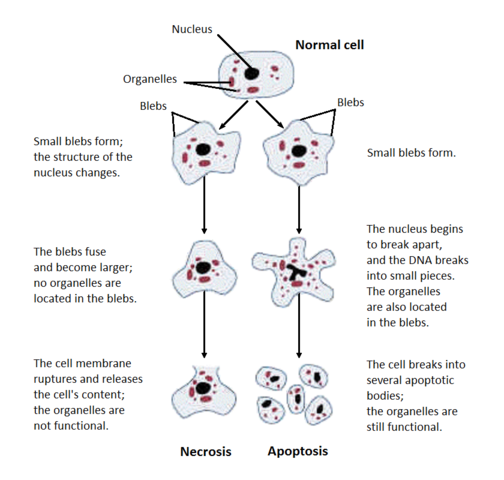
Esta palestra abrangerá duas formas diferentes de células poderem morrer: apoptose (morte celular programada) e necrose (morte celular não planeada). É fácil distinguir estas duas morfologias sob o microscópio, como mostra esta imagem do Wikimedia Commons:
 p>necrosis
p>necrosis
Necrose é quando as células morrem acidentalmente devido a, digamos, trauma (ex. uma picada de aranha venenosa), ou falta de nutrientes (ex. falta de fornecimento de sangue). A necrose começa com o inchaço celular, a cromatina é digerida, o plasma e as membranas das organelas são perturbadas, as ER vacuolizam, as organelas decompõem-se completamente e finalmente as células lise, vomitando o seu conteúdo intracelular e provocando uma resposta imunitária (inflamação).
apoptose
Apoptose pode constituir suicídio celular ou homicídio celular. As células cometerão suicídio quando lhes faltar qualquer sinal de sobrevivência sob a forma de factores tróficos, ou quando detectarem danos extensos de ADN no seu próprio núcleo. As células matarão outras células para eliminar células desnecessárias ou para eliminar células imunitárias potencialmente auto-atactivas.
p> Qualquer um destes processos constitui morte celular programada. Durante o desenvolvimento embrionário, as pessoas têm mãos e pés e caudas; as células que constituem essas partes apoperam mais tarde. A apoptose também ocorre constantemente em muitos tecidos, incluindo os intestinos.
Aqui está uma impressionante imagem Wikimedia Commons da apoptose (ler da esquerda para a direita, de cima para baixo) graças a Egelberg:
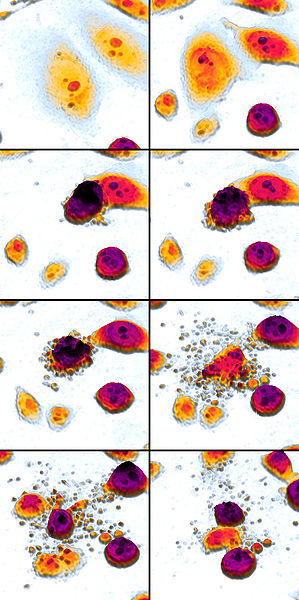
P>P>Passos maiores da apoptose:
- Células encolhem
- Fragmentos de células
- Cytoskeleton colapsa
- Desmontagens de envelopes nucleares
- Células libertam corpos apoptóticos
Notavelmente ausente desta lista está “enviar um sinal”.’ As células apoptóticas não enviam qualquer sinal, com uma excepção: libertam corpos apoptóticos e “proteínas de engolir” para induzir outras células (“células fagocitárias”) a engolir os corpos apoptóticos e quebrá-los nos seus lisossomas, mas isto não é uma grande resposta imunitária.
Proteínas importantes na apoptose:
- “proteínas assassinas”: as caspases (discutidas em detalhe abaixo).
- “proteínas de destruição” que digerem o ADN, fragmentarem a célula e decomporem o citoesqueleto
- “proteínas de engolfamento” que provocam e promovem a fagocitose por outras células
C. elegans tem sido o principal organismo modelo para a compreensão da apoptose, tanto pela genética directa como pela genética inversa. A genética avançada está a observar um fenótipo e depois a determinar qual o gene que lhe dá origem; a genética inversa está a introduzir uma mutação num gene conhecido, a fim de ver que fenótipo resulta.
O caminho-chave em C. elegans apoptosis é mostrado neste desenho do Google que criei:
Aqui está uma explicação de como cada uma destas proteínas faz o seu trabalho, de baixo para cima:
are:
- CED-3 puxa o gatilho, activando proteínas apoptóticas que destroem a célula. (No equivalente mamífero, CED-3 é Caspase 9, que cliva-tereby-activando Caspase 3, que por sua vez destrói a célula.)
- CED-9 liga-se ao CED-4, impedindo a sua activação
- EGL-1 é activado por transcrição em resposta a sinais de morte e catalisa a libertação do CED-4 do CED-9.
li>CED-4 activa o CED-3.
Nota que não há robustez neste sistema – são pontos únicos de falha durante todo o percurso. Se o CED-3 for eliminado, não pode ocorrer apoptose. Se o CED-4 for eliminado, não pode ocorrer apoptose. Se o CED-9 for eliminado, todas as células do verme irão apoptose. Se o EGL-1 for eliminado, não pode ocorrer apoptose. Note-se que a ordem em que as setas apontam no diagrama acima reflecte o fluxo de informação no sistema. Por exemplo, se EGL-1 e CED-9 forem ambos eliminados, é o mesmo que se CED-9 sozinho fosse eliminado: cada célula apoptose.
Em mamíferos, a apoptose é governada principalmente por caspases (proteases cisteina-aspárticas). Toda a via de caspase é regulada pós-tradução: as caspases estão sempre presentes na forma inactiva (chamadas procaspases, contendo um prodomínio, que contém um domínio de recrutamento de caspase (CARD)) e podem ser activadas por clivagem. Isto permite uma resposta muito rápida se for necessário o suicídio celular. Para que a apoptose ocorra, as caspases iniciadoras devem ser clivadas e dimerizadas. Assim activadas, devem então clivar as caspases effector (também conhecidas como caspases pró-caspases), desencadeando uma “cascata de caspases”. Isto amplifica o número de caspases activadas na célula. As caspases efetoras têm muitos alvos, incluindo a lâmina nuclear e o citoesqueleto.
Existem caspases pró-sobrevivência e pró-apoptóticas, e partilham muitos domínios comuns. As caspases pró-apoptose têm BH1, 2, 3 e 4; as caspases pró-apoptose têm ou BH1, 2 e 3 ou apenas BH3.
Inibidor de proteínas de apoptose (IAPs) restringem tanto o iniciador como as caspases effector. Cada um deles tem um domínio de ligação de zinco que se liga directamente às caspases, inibindo a sua actividade.
No entanto, existem também proteínas mitocondriais chamadas SMAC e DIABLO que inibem os inibidores. Após a lesão mitocondrial são libertadas e ligam-se aos IAPs, libertando as caspases para causar a apoptose. Outra colecção de proteínas mitocondriais chamada Htra2/Omi, factor indutor de apoptose (AIF) e endonuclease G pode também ser libertada e irá clivar os IAPs. AIF também causa condensação cromossómica e fragmentação do ADN independentemente das caspases.
Indeed, as mitocôndrias são reguladores centrais da apoptose. As proteínas da membrana mitocondrial externa Bcl-2, as proteínas apenas BH3 e Bax estão envolvidas: A Bax pode formar um poro na membrana para permitir que o citocromo c, normalmente localizado no espaço intermembrana, saia para o citosol. Os monómeros de Bax deslocam-se do citoplasma para a membrana mitocondrial externa, onde oligomerizam e permitem o influxo de iões através da membrana. Isto também foi demonstrado em experiências in vitro onde se pode mostrar que as vesículas feitas de membranas mitocondriais externas são permeabilizadas na presença de Bax. Não se sabe actualmente porque é que este influxo de iões leva à libertação de citocromo c.
Bcl-2 impede a libertação de citocromo c, bloqueando assim a apoptose. Bcl-2 foi o primeiro gene de apoptose de mamífero a ser clonado. Em alguns linfomas, é translocado para uma posição sob um promotor mais forte, causando uma sobreexpressão que impede a apoptose da célula cancerígena. Ver também bad & bid.
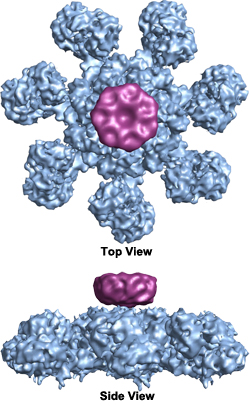
Once cytochrome c é libertado, liga-se ao Apaf-1 (factor activador da protease apoptótica), fazendo com que este último hidrolise o ATP ao qual está normalmente ligado, causando assim uma alteração conformacional que activa o Apaf-1 e desencadeia a cascata de caspase. O Apaf-1 forma um heptâmero em forma de disco chamado “roda da morte” ou apoptosoma que activa as caspases (imagem Wikimedia Commons por Org1012):
Quando um factor trófico está presente, o receptor activa o PI3K, que activa o PKB/Akt, que fosforilatos Mau. O p-Bad é então retido no citosol por 14-3-3, impedindo o p-Bad de inibir o Bcl-2. Assim a apoptose é evitada.
Factores atróficos são um exemplo de um sinal extrínseco de célula que promove a sobrevivência. Há também sinais extrínsecos que promovem a morte (isto é homicídio celular). O factor de necrose tumoral (TNF-alfa) é libertado por macrófagos para desencadear a morte celular através da ligação a “receptores de morte”. Os receptores de morte têm um único domínio transmembrana. Devem trimerizar a fim de activar FADD (Fas-associated death domain). Estes servem como adaptadores para caspase-8 e -10 e formam um complexo de sinalização indutora de morte (DISC) que pode iniciar a cascata de caspase. Embora todo este processo tenha origem independente das mitocôndrias, também pode activar (?) t-Bid, levando também a um sinal de apoptose mitocondrial.
Células podem tornar-se resistentes ao homicídio expressando receptores de engodo que têm apenas o domínio de ligação ‘death ligand’ e nenhum domínio citosólico activo. Isto ocorre por vezes normalmente em células animais mas é também um truque que alguns vírus utilizam – codificam proteínas receptoras de engodo para manter as suas células hospedeiras a salvo de ataques imunitários.
TNF-alfa normalmente promove a morte, mas também pode promover a sobrevivência em certos tipos de células, activando NF-κB. Por vezes as células utilizam receptores de engodo para promover uma resposta inflamatória em vez da morte.
p53 é um regulador chave da resposta aos danos do DNA e pode promover a reparação do DNA, apoptose ou paragem do ciclo celular. Faz isto através da ligação a promotores de genes alvo. Ainda não é claro o que determina quando a p53 irá induzir a paragem do ciclo celular versus a apoptose.
métodos experimentais
célulasApoptóticas exibem uma assinatura química particular. Uma delas é que uma endonuclease divide o ADN em fragmentos nas regiões de ligação entre os nucleossomas e os fragmentos resultantes formam uma escada quando correm sobre um gel. Outra é a coloração de TUNEL (Terminal deoxinucleotide transferase dUTP Nick End Labeling). Isto envolve a adição de uma enzima Tdt e uma BrdU que a Tdt irá adicionar às extremidades do ADN clivado. Depois de lhe dar uma oportunidade de o fazer, lava-se o excesso de BrdU e depois usa-se um anticorpo contra BrdU. Ainda outro método é que a fosfatidilserina (PS) está normalmente localizada no folheto citosólico da membrana plasmática; durante a apoptose, ela vira para o folheto exoplásmico, onde serve como sinal para solicitar a outras células que fagocitose a célula moribunda. Uma proteína de anexo em V fluorescentemente rotulada pode rotular PS no exterior das células apoptóticas.
p>O ADN de cadeia dupla não pode atravessar a membrana plasmática das células intactas – e isso significa células saudáveis e células apoptóticas. Se sair, isso é um sinal de necrose. Assim, pode manchar com a anexina V para PS exoplásmica e com 7-AAD para dsDNA; as células apoptóticas são as que são positivas para a anexina V, mas negativas para o 7-AAD.
vídeo conclusivo
em suma, aqui está um vídeo perturbador sobre apoptose:
relevância à PrP
em geral, na natureza, as células ou morrem por apoptose, necrose ou por autofagia (significando, neste caso, serem engolidas inteiras por outras células). Não há realmente outros caminhos a seguir. Uma das muitas coisas misteriosas sobre as doenças priónicas é como os neurónios morrem no cérebro infectado por priões – não parecem obviamente seguir qualquer um destes caminhos. Aqui está uma citação de um excelente artigo recente sobre mecanismos tóxicos da doença priónica :
Caspase 12 clivagem ocorreu a 10wpi, após a expressão CHOP crescente… coincidindo com o início da perda neuronal… no entanto o mecanismo de efeito exacto da morte neuronal não é claro: não encontramos apoptose, nem autofagia, nem necrose no exame das fatias hipocampais… e nem a supressão de Bax, nem a sobreexpressão de Bcl-2, nem a deficiência de caspase 12 são neuroprotectoras na doença priónica.
Além da sua própria evidência, Moreno cita o estudo da infecção por priões em modelos de ratos com Bax (uma proteína pró-apoptótica) eliminada ou Bcl-2 (uma proteína anti-apoptótica) sobreexpressa – duas formas diferentes de bloquear a apoptose. Nenhum destes modelos de ratos teve qualquer atraso ou melhoria da doença do prião. Outra proteína apoptótica, Caspase-12, sofre um processamento proteolítico durante a infecção por priões, mas a eliminação da Caspase-12 também não alterou o curso da doença do prião .