Aminoglicosídeos mostram actividade bactericida dependente da concentração contra “a maioria dos bacilos aeróbios gram-negativos e anaeróbios facultativos” mas não contra os anaeróbios gram-negativos e a maioria das bactérias gram-positivas. Requerem apenas pouco tempo de contacto, e são mais eficazes contra populações bacterianas susceptíveis que se estão a multiplicar rapidamente. Estas actividades são atribuídas a um modo de acção primário como inibidores da síntese proteica, embora mecanismos adicionais estejam implicados para alguns agentes específicos, e/ou descrições mecanicistas completas ainda não estejam disponíveis.
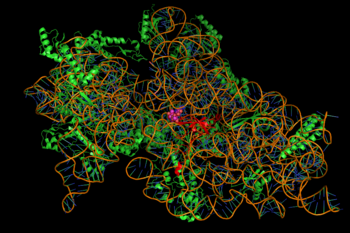
A inibição da síntese proteica é mediada através da ligação dependente da energia dos aminoglicosídeos, por vezes irreversível, ao ribossoma bacteriano citosólico, associado à membrana (imagem à direita). (Aminoglicosídeos primeiro cruzam as paredes celulares bacterianas – lipopolissacarídeo em bactérias gram-negativas e membranas celulares, onde são activamente transportados). Enquanto as etapas específicas da síntese de proteínas afectadas podem variar um pouco entre agentes aminoglicosídeos específicos, assim como a sua afinidade e grau de ligação, a presença de aminoglicosídeos no citosol geralmente perturba o alongamento do peptídeo na subunidade ribossómica 30S, dando origem a uma tradução imprecisa do mRNA e, portanto, biossíntese de proteínas que são truncadas, ou suportam composições alteradas de aminoácidos em determinados pontos. Especificamente, a ligação prejudica a revisão translacional, levando a uma leitura errada da mensagem de RNA, terminação prematura, ou ambas, e assim à imprecisão do produto proteico traduzido. O subconjunto de proteínas aberrantes que são incorporadas na membrana celular bacteriana pode então levar a alterações na sua permeabilidade e depois a “maior estimulação do transporte de aminoglicosídeos”. A porção de aminoácidos desta classe de moléculas (por exemplo, a 2-deoxistroptamina em canamicinas, gentamicinas, e tobramicina, ver acima) estão implicadas na associação da pequena molécula com estruturas ribossómicas que levam às infidelidades na tradução (ibid.). A inibição da translocação do ribossómio – isto é, o movimento do peptidyl-tRNA do A- para o P-site – também foi sugerido. Experiências recentes de rastreio de uma única molécula em E. coli viva mostraram uma síntese contínua mas mais lenta de proteínas após tratamento com diferentes drogas aminoglicosídicas. (Spectinomicina, uma classe de estrutura química relacionada mas distinta frequentemente discutida com aminoglicosídeos, não induz a leitura errada do mRNA e geralmente não é bactericida.)
Finalmente, um outro “efeito de membrana celular” também ocorre com aminoglicosídeos; “a integridade funcional da membrana celular bacteriana” pode ser perdida, mais tarde, em cursos temporais de exposição e transporte de aminoglicosídeos.
Farmacocinética e farmacodinâmicaEditar
Existe uma variabilidade significativa na relação entre a dose administrada e o nível plasmático resultante no sangue. A monitorização de fármacos terapêuticos (TDM) é necessária para obter a dose correcta. Estes agentes exibem um efeito pós-antibiótico no qual não há nenhum ou muito pouco nível de droga detectável no sangue, mas ainda parece haver inibição do crescimento bacteriano. Isto deve-se a uma ligação forte e irreversível ao ribossoma, e permanece intracelular muito tempo após a queda dos níveis de plasma, e permite um intervalo de dosagem prolongado. Dependendo da sua concentração, actuam como agentes bacteriostáticos ou bactericidas.
IndicaçõesEditar
Aminoglicosídeos são úteis principalmente em infecções envolvendo bactérias aeróbicas, Gram-negativas, tais como Pseudomonas, Acinetobacter, e Enterobacter. Além disso, algumas micobactérias, incluindo as bactérias que causam a tuberculose, são susceptíveis aos aminoglicosídeos. A estreptomicina foi a primeira droga eficaz no tratamento da tuberculose, embora o papel dos aminoglicosídeos como a estreptomicina e amikacina tenha sido eclipsado (devido à sua toxicidade e via de administração inconveniente), excepto para as estirpes resistentes a múltiplas drogas. A utilização mais frequente de aminoglicosídeos é a terapia empírica para infecções graves como a sepse, infecções intra-abdominais complicadas, infecções complicadas do tracto urinário e infecções do tracto respiratório nosocomial. Normalmente, uma vez cultivadas as culturas do organismo causal e testadas as suas susceptibilidades, os aminoglicosídeos são descontinuados a favor de antibióticos menos tóxicos.
Como observado, os aminoglicosídeos são na sua maioria ineficazes contra bactérias anaeróbias, fungos, e vírus. As infecções causadas por bactérias Gram-positivas também podem ser tratadas com aminoglicosídeos, mas outros tipos de antibióticos são mais potentes e menos prejudiciais para o hospedeiro. No passado, os aminoglicosídeos foram utilizados em conjunto com antibióticos beta-lactâmicos em infecções estreptocócicas pelos seus efeitos sinérgicos, em particular na endocardite. Uma das combinações mais frequentes é a ampicilina (um antibiótico relacionado com beta-lactam, ou penicilina) e a gentamicina. Muitas vezes, o pessoal hospitalar refere-se a esta combinação como “amp e gent” ou mais recentemente chamada “pen e gent” para penicilina e gentamicina.
Supressão sem sentidoEditar
A interferência com a revisão do mRNA foi explorada para tratar doenças genéticas que resultam de códones de paragem prematura (levando ao fim precoce da síntese de proteínas e proteínas truncadas). Os aminoglicosídeos podem fazer com que a célula ultrapasse os códons de paragem, inserir um aminoácido aleatório, e exprimir uma proteína de comprimento total. A gentamicina aminoglicosídica tem sido utilizada para tratar células de fibrose cística (FC) no laboratório para as induzir a crescer proteínas de comprimento total. A CF é causada por uma mutação na codificação genética para a proteína do regulador de condutância da fibrose cística transmembrana (CFTR). Em aproximadamente 10% dos casos de CF, a mutação neste gene causa o seu término precoce durante a tradução, levando à formação de uma proteína CFTR truncada e não funcional. Acredita-se que a gentamicina distorce a estrutura do complexo ribosome-RNA, levando a uma leitura errada do códão de terminação, fazendo com que o ribossoma “salte” sobre a sequência de paragem e continue com o alongamento e produção normal da proteína CFTR.