A Lei de Lambert de Cerveja (também chamada Lei de Cerveja) é uma relação entre a atenuação da luz através de uma substância e as propriedades dessa substância. Neste post de blogue, as definições de transmitância e absorvância da luz por uma substância são primeiro introduzidas, seguidas de uma explicação da Lei de Beer-Lambert.
O que são transmitância e absorvância?
Considerar luz monocromática transmitida através de uma solução; com uma intensidade incidente de I0 e uma intensidade transmitida de I (Figura 1).
A transmitância, T, da solução é definida como a razão da intensidade transmitida, I, sobre a intensidade incidente, I0:
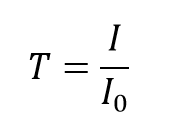
e toma valores entre 0 e 1. Contudo, é mais comummente expressa como uma transmitância percentual:
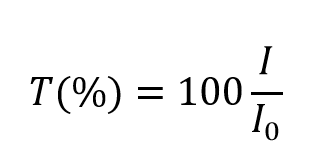
A absorvância, A, da solução está relacionada com a transmitância e as intensidades incidentes e transmitidas através das seguintes relações:
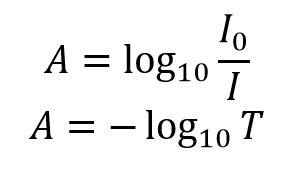
A absorvância tem uma relação logarítmica com a transmitância; com uma absorvância de 0 correspondente a uma transmitância de 100% e uma absorvância de 1 correspondente a uma transmitância de 10%. Os valores adicionais da transmitância e dos pares de absorvâncias são apresentados no Quadro 1. Uma demonstração visual do efeito que a absorvância de uma solução tem na luz de atenuação que passa através dela é mostrada na figura 2, onde um laser de 510 nm passa por três soluções de Rodamina 6G com absorvância diferente.
Quadro 1: Valores de Absorbância e Transmitância:
| Absorbance | Transmittance |
|---|---|
| 0 | 100% |
| 10% | |
| 2 | 1% |
| 4 | 0.01% |
| 5 | 0.001% |
 A Lei Beer-Lambert: atenuação da luz através de soluções de absorvância diferente
A Lei Beer-Lambert: atenuação da luz através de soluções de absorvância diferente
Figure 2: Atenuação de um laser de 510 nm através de três soluções de Rhodamine 6G com diferentes valores de absorvância a 510 nm. O brilho amarelo é a emissão de fluorescência a ~560 nm.
Absorbância é uma quantidade sem dimensão e deve, portanto, ser sem unidades. No entanto, é bastante comum ver unidades de AU declaradas após a absorvância, o que significa ou unidades arbitrárias ou unidades de absorvância. Estas unidades são redundantes e devem ser evitadas. Outro encontro comum é a utilização do termo densidade óptica ou DO em vez de absorvância. Densidade óptica é um termo mais antigo que, no contexto da espectroscopia de absorção, é sinónimo de absorvância; contudo, o uso de densidade óptica em vez de absorvância é desencorajado pela IUPAC.1
Qual é a Lei Beer-Lambert?
A Lei Beer-Lambert é uma relação linear entre a absorvância e a concentração, coeficiente de absorção molar e coeficiente óptico de uma solução:

O coeficiente de absorção molar é uma propriedade dependente da amostra e é uma medida de quão forte é um absorvente a um determinado comprimento de onda de luz. A concentração é simplesmente as toupeiras L-1 (M) da amostra dissolvida na solução, e o comprimento é o comprimento da cubeta utilizada para a medição da absorvância e é tipicamente 1 cm.
A lei Beer-Lambert afirma que existe uma relação linear entre a concentração e a absorvância da solução, o que permite calcular a concentração de uma solução através da medição da sua absorvância. Para demonstrar esta dependência linear foram medidas cinco soluções de Rodamina B em água utilizando o Espectrofotómetro de Feixe Duplo DS5 (Figura 3a) e a partir destes espectros de absorção, foi criada uma curva de calibração linear da absorvância versus concentração (Figura 3b). Usando esta curva de calibração, a concentração de uma solução desconhecida de Rhodamine B pode ser determinada medindo a sua absorvância, que é a principal utilidade da Lei Beer-Lambert.
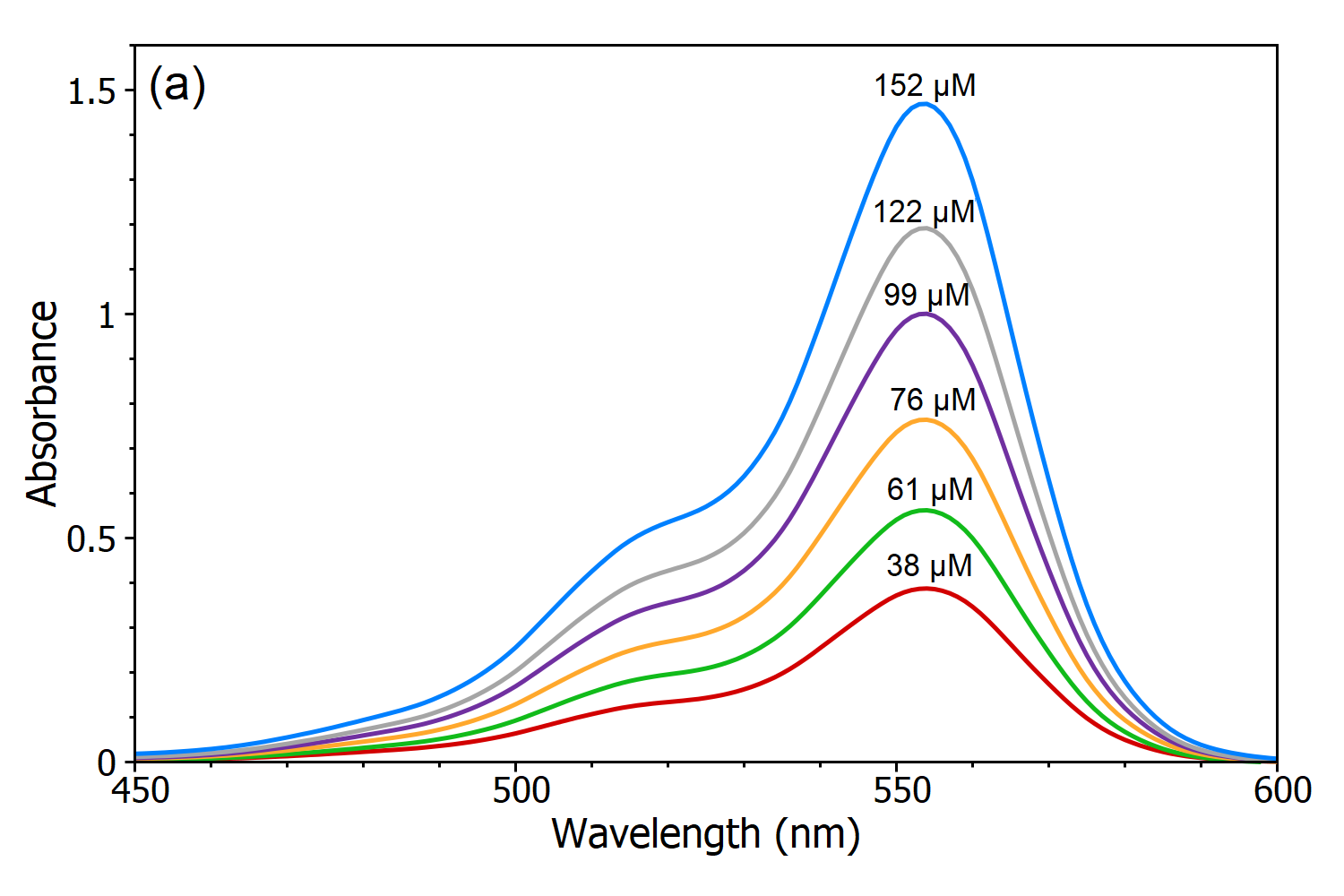

Figure 3 (a): Espectrofotómetro de Absorção de Rhodamina B com diferentes concentrações em água, medido utilizando o Espectrofotómetro de Feixe Duplo DS5. (b) Curva de calibração da Rodamina B na água medida em λmax.
Para mais informações sobre a teoria da espectroscopia de absorção, consulte a secção de perguntas frequentes no nosso blog.