Condutividade
Outra propriedade característica dos compostos iónicos é a sua condutividade eléctrica. A figura abaixo mostra três experiências em que dois eléctrodos ligados a uma lâmpada são colocados em copos contendo três substâncias diferentes.
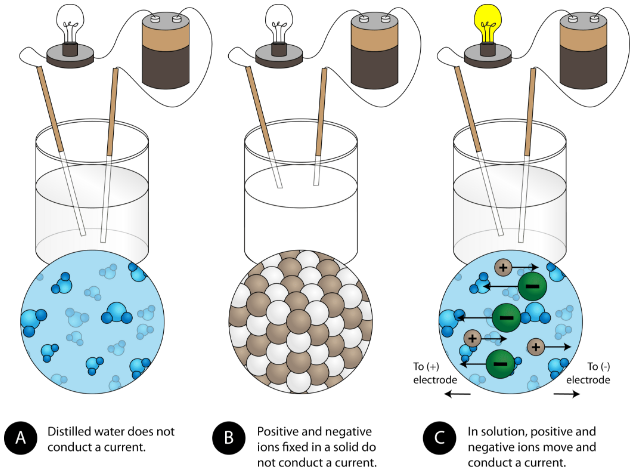
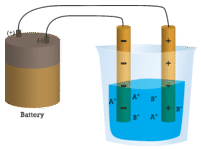
No primeiro copo, a água destilada não conduz uma corrente porque a água é um composto molecular. No segundo copo, o cloreto de sódio sólido também não conduz uma corrente. Apesar de ser iónico e, portanto, composto de partículas carregadas, a malha de cristal sólido não permite que os iões se movam entre os eléctrodos. As partículas carregadas móveis são necessárias para que o circuito esteja completo e a lâmpada acenda-se. No terceiro béquer, o NaCl foi dissolvido na água destilada. Agora, a malha de cristal foi quebrada e os iões positivos e negativos individuais podem mover-se. Os catiões deslocam-se para um eléctrodo, enquanto os ânions se deslocam para o outro, permitindo que a electricidade flua (ver figura abaixo). A fusão de um composto iónico também liberta os iões para conduzir uma corrente. Os compostos iónicos conduzem uma corrente eléctrica quando derretidos ou dissolvidos em água. A dissolução de compostos iónicos na água será discutida na Secção 9.3.
Exemplo \(\PageIndex{1})
p>Escrever a equação de dissociação do NaCl sólido na água.
Solução
NaCl(s) → Na+(aq) + Cl-(aq)
Exercicio \(\PageIndex{1})
Escrever a equação de dissociação do NH4NO3 sólido na água.
Resposta
NH4NO3(s) → NH4+(aq) + NO3-(aq)