Ostra zdekompensowana niewydolność serca (ADHF) pozostaje jednym z najczęstszych powodów hospitalizacji. Pacjenci z ADHF, u których występują schorzenia współistniejące, stanowią uporczywe wyzwanie dla szpitalników. A ADHF jest często obserwowana u pacjentów w wieku 65 lat i starszych. Aktywacja neurohormonalna, która jest konsekwencją dysfunkcji mięśnia sercowego, prowadzi do stopniowego pogarszania się stanu serca i zaburzeń hemodynamicznych, które ostatecznie manifestują się jako ostra zdekompensowana niewydolność serca.
Celem postępowania w ADHF jest stabilizacja stanu pacjenta, opanowanie ostrych zaburzeń hemodynamicznych, odwrócenie objawów duszności spowodowanej przeciążeniem płynami oraz rozpoczęcie terapii opartej na dowodach naukowych w celu zmniejszenia progresji choroby i poprawy przeżywalności.
W tym artykule przedstawiamy przypadek 26-letniej kobiety z ADHF i podkreślamy strategie postępowania, które mogą doprowadzić do stabilizacji i poprawy długoterminowych wyników leczenia.
 kliknij, aby powiększyć
kliknij, aby powiększyć
Rycina 1. RA = ciśnienie w prawym przedsionku, PCWP = ciśnienie zaklinowania w kapilarach płucnych
Wprowadzenie
Mimo znacznego postępu w leczeniu chorób serca, niewydolność serca pozostaje rosnącym problemem zdrowia publicznego o proporcjach epidemicznych w Stanach Zjednoczonych. Około pięciu milionów Amerykanów cierpi na niewydolność serca, a każdego roku rozpoznaje się ją u ponad 550 000 pacjentów.1 Roczna liczba hospitalizacji z powodu niewydolności serca jako rozpoznania podstawowego wzrosła z około 810 000 w 1990 roku do ponad 1 miliona w 1999 roku i jest to najczęstsza grupa związana z rozpoznaniem wypisowym u pacjentów w wieku 65 lat i starszych.2 Medicare wydało więcej dolarów na diagnostykę i leczenie niewydolności serca niż na jakiekolwiek inne rozpoznanie – ponad 27,9 miliarda dolarów w 2005 roku.1
Pacjenci zgłaszający się na oddział ratunkowy (ED) z ADHF są często niestabilni hemodynamicznie, z ciężkimi objawami duszności i przeciążenia płynami. Szybka ocena i rozpoczęcie odpowiednich interwencji są niezbędne do osiągnięcia stabilności klinicznej i zapobieżenia przedłużonemu pobytowi w szpitalu, jeśli hospitalizacja jest konieczna. Śmiertelność wewnątrzszpitalna w przypadku ADHF wynosi 5%-8%; mediana czasu hospitalizacji wynosi pięć dni, a wskaźnik ponownej hospitalizacji po sześciu miesiącach wynosi około 50%.1,3 Jest więc oczywiste, że lepsze rozpoznawanie i leczenie są niezwykle ważne. Mając te cele na uwadze, przedstawiamy niedawno opisany przypadek, który podkreśla wiele obaw związanych z ADHF i możliwości jej leczenia.
 kliknij, aby powiększyć
kliknij, aby powiększyć
Rycina 1. RA = ciśnienie w prawym przedsionku, PCWP = ciśnienie zaklinowania w kapilarach płucnych
Prezentacja przypadku
Karen A. jest 26-letnią czarną kobietą z chorobą Hodgkina w stadium III, rozpoznaną w 2000 roku. Otrzymywała chemioterapię (cisplatyna, cytarabina, doksorubicyna, rytuksan, gemcytabina) i w rezultacie w 2001 roku rozwinęła się u niej kardiomiopatia wywołana chemioterapią z frakcją wyrzutową <20%. Jej stan ustabilizował się i pozostawała w remisji klinicznej do września 2002 roku.
W 2003 roku otrzymała autologiczny przeszczep komórek macierzystych, a następnie zgłosiła się na izbę przyjęć ze skargami na zmęczenie, postępującą duszność w ciągu ostatnich siedmiu dni i obrzęki kończyn dolnych. Zgłaszała również prawostronny opłucnowy ból w klatce piersiowej, ale zaprzeczała towarzyszącym mu nudnościom, wymiotom lub pieluchomajtkom. W ciągu trzech dni poprzedzających przyjęcie do szpitala przytyła 10 funtów. W ciągu ostatnich sześciu miesięcy była wielokrotnie hospitalizowana z powodu ADHF.
Badanie przedmiotowe ujawniło czujną, otyłą kobietę z umiarkowaną niewydolnością oddechową i suchymi błonami śluzowymi. Jej parametry życiowe wskazywały na temperaturę 36,5° C, częstość akcji serca 110 uderzeń na minutę, częstość oddechów 20 oddechów na minutę, ciśnienie tętnicze 111/73 mm Hg i saturację tlenem 92%. Nie miała zaczerwienienia twardówki, ale miała żylną dystocję szyjną do kąta żuchwy w pozycji wyprostowanej pod kątem 45°. Badanie serca wykazało tachykardię z odległymi dźwiękami serca i słyszalnym trzecim dźwiękiem serca (S3), a także szmer skurczowy 2/6 stopnia na lewej granicy mostka. W badaniu płuc stwierdzono rozsiane trzeszczenia w obu polach płucnych, ale bez świszczącego oddechu. Badanie jamy brzusznej wykazało tkliwość przy palpacji w prawym podżebrzu i hepatomegalię, skóra była ciepła i sucha, bez sinicy, a kończyny wykazywały znaczny obustronny obrzęk wżerowy przed piszczelami do kolan.
 kliknij aby powiększyć
kliknij aby powiększyć
Rycina 1. RA = ciśnienie w prawym przedsionku, PCWP = ciśnienie zaklinowania w kapilarach płucnych
Jej aktualne leki obejmowały:
- Furosemid, 60 mg doustnie dwa razy na dobę;
- Karwedilol, 12.5 mg doustnie rano, 6,25 mg wieczorem;
- Amiodaron, 200 mg doustnie codziennie; i
- Digoxin, 0,125 mg doustnie codziennie.
Wyniki badań laboratoryjnych obejmowały prawidłowe elektrolity, azot mocznikowy we krwi i kreatyninę w surowicy. Jej hemoglobina wynosiła 11,3 gm/L, a poziom peptydu natriuretycznego typu B (BNP) 4 837 pg/ml. Wstępne oznaczenia enzymów sercowych były ujemne (troponina I <0. 03).
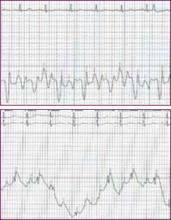
Rtg klatki piersiowej wykazało umiarkowane powiększenie serca z obustronnym pogrubieniem linii przegrody podprzeponowej i zatarciem naczyń płucnych, co wskazuje na rozwijający się kardiogenny obrzęk płuc. W 12-odprowadzeniowym elektrokardiogramie stwierdzono tachykardię zatokową o częstości 110 uderzeń na minutę oraz niespecyficzne zmiany załamka ST-T w odprowadzeniach dolnych, nie odnotowano natomiast załamków Q. W badaniu echokardiograficznym stwierdzono znacznie upośledzoną funkcję skurczową lewej komory z ciężką globalną hipokinezą lewej komory i frakcją wyrzutową 25%-30%. Nie stwierdzono wysięku w osierdziu.
Pacjentka została przyjęta na oddział telemetrii z rozpoznaniem ADHF. Podawano jej tlen i seryjnie oznaczano enzymy sercowe, a elektrokardiogram nie wykazywał cech uszkodzenia lub niedokrwienia. Rozpoczęto podawanie dożylne furosemidu w dawce 40 mg co 12 godzin. Po 24 godzinach podano bolus nesiritidu (2 mcg/kg), a następnie wlew ciągły w dawce 0,01 mcg/kg/min. Kontynuowano podawanie leków nasercowych, a dawkę karwedilolu zmniejszono do 6,25 mg doustnie 2 razy na dobę.
Po okresie diurezy chora pozostawała bardzo objawowa, dlatego wykonano cewnikowanie prawego serca. Badanie hemodynamiczne wykazało rzut serca wynoszący 3 litry na minutę, ciśnienie w prawym przedsionku 20 mm Hg, ciśnienie w prawej komorze 70/20 mm Hg, ciśnienie w tętnicy płucnej 66/20 mm Hg ze średnim ciśnieniem 52 mm Hg oraz ciśnienie zaklinowania w kapilarach płucnych 25 mm Hg. (Patrz ryc. 1 i 2, str. 23).
W ciągu następnych 24 godzin pacjent miał ponad trzy litry wydalanego moczu i nastąpiła u niego znaczna poprawa. Wlew nesiritydu przerwano po 48 godzinach terapii, a pacjent został odstawiony od dodatkowego tlenu. Rozpoczęto podawanie lisinoprilu w dawce 2,5 mg doustnie na dobę. W czwartej dobie pobytu w szpitalu pacjentka chodziła wokół stanowiska pielęgniarek bez dodatkowego tlenu i powrócono do poprzedniej dawki furosemidu, 60 mg dwa razy dziennie.
Pacjentka została włączona do Heart Success Program (HSP), interdyscyplinarnego programu współpracy, który jest dostępny w naszej instytucji dla pacjentów z niewydolnością serca. Pacjentka otrzymała materiały edukacyjne dla pacjentów, w tym kasety wideo na temat postępowania w niewydolności serca, codziennego monitorowania masy ciała, diety, leków, ćwiczeń fizycznych i emocjonalnych aspektów niewydolności serca. Pielęgniarki z przeszkoleniem w zakresie niewydolności serca były dostępne, aby odpowiadać na pytania pacjentki i udzielać dalszych instrukcji dotyczących obserwacji po wypisaniu pacjentki ze szpitala. Stan pacjentki poprawił się na tyle, że była w stanie zapisać się do II klasy New York Heart Association (NYHA) i została wypisana po pięciu dniach, z wizytą kontrolną w ambulatorium tydzień po wypisie ze szpitala.
Dyskusja
Ten przypadek ilustruje wyzwania związane z rozpoznaniem i postępowaniem w ADHF u pacjenta z nowotworem, u którego znana jest niewydolność serca w wywiadzie. Szybka ocena jest kluczowa w ustaleniu rozpoznania i podjęciu odpowiedniej interwencji. Cele postępowania w ADHF pozostają takie same, niezależnie od etiologii. Obejmują one stabilizację stanu pacjenta, opanowanie ostrych zaburzeń hemodynamicznych, odwrócenie objawów duszności spowodowanej przeciążeniem płynami oraz rozpoczęcie terapii opartej na dowodach naukowych w celu zmniejszenia progresji choroby i poprawy przeżywalności. Te same zasady obowiązują nawet wtedy, gdy u pacjenta występują poważne choroby współistniejące, takie jak rak, a podejrzenie rozpoznania musi pozostać wysokie.
Ocena wstępna
Wczesne rozpoznanie i skuteczne leczenie ADHF są niezwykle ważne, ponieważ wykazano, że zmniejszają liczbę hospitalizacji i przyjęć na oddziały intensywnej terapii, skracają czas pobytu w szpitalu i zmniejszają koszty hospitalizacji.4 Należy przeprowadzić kompleksowy wywiad i badanie fizykalne w celu zidentyfikowania oznak i objawów, które mogą prowadzić do rozpoznania niewydolności serca.
Musimy ocenić takie potencjalne czynniki ryzyka, jak nadciśnienie tętnicze, dyslipidemia, cukrzyca, choroba wieńcowa, choroba zastawek, choroba naczyń obwodowych, kardiomiopatia w wywiadzie rodzinnym, palenie tytoniu, spożywanie alkoholu, problemy z tarczycą, bezdech senny i wszelkie przebyte ostatnio infekcje (zwłaszcza infekcje górnych dróg oddechowych, które mogą powodować kardiomiopatię wirusową).
Jako część dalszych badań u pacjentów z chorobą nowotworową, należy uwzględnić ewentualną ekspozycję pacjenta w przeszłości na czynniki kardiotoksyczne (np, antracykliny, trastuzumab, cyklofosfamid w dużych dawkach) lub napromienianie śródpiersia. Kardiomiopatia wywołana chemioterapią staje się coraz większym problemem w leczeniu niewydolności serca w związku z rosnącą liczbą osób, które przeżyły długotrwałe leczenie nowotworów i otrzymały chemioterapię zawierającą antracykliny lub inną agresywną terapię.
Podczas oceny przedmiotowej każdego pacjenta należy skupić się na objętości i stanie perfuzji. Większość pacjentów zgłaszających się do ED z ostrą dekompensacją jest przeciążona objętościowo. Objawami przeciążenia objętościowego są: duszność, bezdech ortoptyczny i napadowa duszność nocna, a także rozszerzenie żył szyjnych, refluks wątrobowo-żuchwowy, wodobrzusze, obrzęk i trzeszczenia w płucach.5 Trzeszczenia nie zawsze są obecne u pacjentów z przewlekłą niewydolnością serca, jednak ze względu na ciągłe przemieszczanie się płynu do śródmiąższu związane ze zwiększonym drenażem limfatycznym, co powoduje, że pęcherzyki płucne pozostają stosunkowo suche.6
Oprócz wyczerpującego wywiadu i badania przedmiotowego, w ustaleniu rozpoznania pomoże kilka badań. Pomiar stężenia peptydu natriuretycznego typu B (BNP) ułatwia rozpoznanie ADHF. BNP jest endogennie wytwarzanym peptydem natriuretycznym, który ulega aktywacji w odpowiedzi na rozszerzenie przedsionków lub komór spowodowane przeciążeniem objętościowym i zwiększonym napięciem ścian.7,8 Krążące stężenie endogennego BNP jest znacznie podwyższone u pacjentów z ADHF i jest cennym narzędziem w diagnostyce niewydolności serca w ED.9-11 U Karen A. stężenie BNP wynosiło 4 837 pg/ml, co wskazuje na niewydolność serca w stadium D. Rozpoznanie to potwierdzono w badaniu radiologicznym klatki piersiowej. Rozpoznanie to zostało potwierdzone w badaniu radiologicznym klatki piersiowej, które wykazało kardiogenny obrzęk płuc z ciężką hipokinezą lewej komory i frakcją wyrzutową wynoszącą 25%-30%.
Mimo że wywiad i badanie przedmiotowe mogą dostarczyć ważnych wskazówek dotyczących zaburzeń pracy serca, do ostatecznego rozpoznania niewydolności serca i oceny potencjalnych czynników zaostrzających konieczne są zarówno badania inwazyjne, jak i nieinwazyjne. Dwuwymiarowy echokardiogram z badaniem przepływu metodą Dopplera jest podstawowym badaniem diagnostycznym pozwalającym ocenić kurczliwość mięśnia sercowego lub frakcję wyrzutową. Echokardiogram pozwala również ocenić inne elementy strukturalne, takie jak osierdzie, stan zastawek oraz parametry hemodynamiczne, które mogą przyczyniać się do rozwoju ADHF. U pacjentów z kardiologicznymi czynnikami ryzyka, test wysiłkowy perfuzji mięśnia sercowego lub cewnikowanie mogą wykazać obecność choroby wieńcowej jako czynnika przyczyniającego się do rozwoju ADHF.
12-odprowadzeniowy elektrokardiogram jest niezbędny do ustalenia rytmu i wykazania dowodów na ostry lub wcześniejszy zawał mięśnia sercowego, zapalenie osierdzia, zaburzenia przewodzenia lub przerost lewej komory w wyniku długotrwałego niekontrolowanego nadciśnienia tętniczego. Wiadomo, że zaburzenia rytmu, takie jak migotanie przedsionków, mogą być czynnikiem poprzedzającym wystąpienie ADHF.
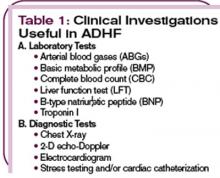
Rtg klatki piersiowej jest konieczne, aby uwidocznić obrzęk płuc w przypadku przeciążenia płynami oraz powiększenie sylwetki serca w przypadku kardiomiopatii rozstrzeniowej. Identyfikacja ostatecznej przyczyny lub przyczyn, które poprzedzają wystąpienie ADHF, jest kluczowa w opracowaniu planu postępowania i rozpoczęciu odpowiedniej interwencji. (Patrz Tabela 2, str. 22.)
 kliknij, aby powiększyć
kliknij, aby powiększyć
Rycina 1. RA = ciśnienie w prawym przedsionku, PCWP = ciśnienie zaklinowania w kapilarach płucnych
Postępowanie doraźne w ADHF
Istnieją nowe wytyczne praktyki klinicznej dotyczące postępowania w ADHF, ale leczenie nadal opiera się w dużej mierze na dowodach empirycznych.12 Leczenie ADHF należy rozpocząć w izbie przyjęć od podania dożylnych leków moczopędnych (o ile nie są przeciwwskazane). Większość pacjentów z ADHF reaguje na same diuretyki.13 Jeśli pacjent źle reaguje na diuretyki, zastosowanie nesiritydu w połączeniu z diuretykami okazało się korzystne, jak wykazała analiza danych z rejestru ADHERE, w której wykazano, że pacjenci leczeni dożylnym nesiritydem mieli mniejszą śmiertelność szpitalną niż pacjenci leczeni milrinonem lub dobutaminą.14 Inne opcje obejmują ultrafiltrację, interwencję, która, jak zauważono, skraca czas pobytu i zmniejsza liczbę ponownych hospitalizacji u pacjentów z ADHF.
Nesiritid jest rekombinowaną postacią BNP bez bezpośredniego działania inotropowego, ale z właściwościami rozszerzającymi naczynia żylne, tętnicze i wieńcowe, co może poprawić objawy ADHF.15 Zalecana dawka nesiritidu to bolus dożylny 2 mcg na kg, a następnie ciągły wlew 0,01 mcg/kg/min. Jednak w przypadku niedociśnienia tętniczego ze skurczowym ciśnieniem tętniczym poniżej 100 mm Hg nie zaleca się podawania początkowej dawki dożylnej w postaci bolusa; zamiast tego pacjent może rozpocząć wlew ciągły 0,01 mcg/kg/min lub rozważyć zastosowanie innych metod leczenia.
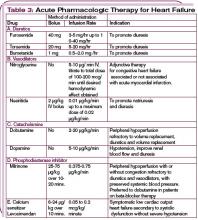
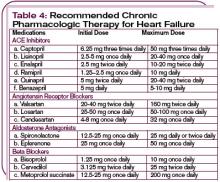
W przypadku niestabilnych hemodynamicznie pacjentów ze skurczowym ciśnieniem tętniczym poniżej 90 mm Hg lub u pacjentów z dowodami na hipoperfuzję narządów końcowych (wstrząs kardiogenny) można rozważyć zastosowanie wsparcia inotropowego do czasu ustabilizowania stanu pacjenta. (Patrz Tabela 3, str. 22.) Należy pamiętać, że środki inotropowe mają niekorzystny wpływ na układ neurohormonalny i nie są zalecane rutynowo, ale mogą być niezbędne do tymczasowej stabilizacji. (Więcej na temat farmakologicznego postępowania w ADHF, patrz Tabela 4, str. 24.)
 click for large version
click for large version
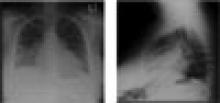
Figure 2. Posteroanterior and lateral chest X-rays showing basilar infiltrates and an enlarged cardiac silhouette
Subacute Management of ADHF
Po odwróceniu ostrej dekompensacji i osiągnięciu stanu euwolemicznego, należy zmienić terapię na kombinację trzech klas leków: diuretyków, inhibitorów konwertazy angiotensyny (ACE) i beta-blokerów, o ile nie są przeciwwskazane. Korzyści ze stosowania tych leków zostały potwierdzone w licznych badaniach klinicznych na dużą skalę.3,12
Inhibitory ACE należy stosować u wszystkich pacjentów z niewydolnością serca spowodowaną dysfunkcją skurczową lewej komory (chyba że są przeciwwskazane lub pacjent ich nie toleruje).3 Inhibitory ACE-I należy podawać pacjentom, u których niedawno wystąpił epizod ADHF, wraz z lekami moczopędnymi w celu utrzymania równowagi sodowej oraz zapobiegania obrzękom obwodowym i płuc. Inhibitory ACE są przeciwwskazane u pacjentek w ciąży i w wieku rozrodczym, a także u osób, u których w przeszłości wystąpił obrzęk naczynioruchowy lub niewydolność nerek po otrzymaniu leku. Należy poinstruować pacjentów, aby unikali nagłych zmian pozycji, ponieważ podczas stosowania inhibitorów ACE może wystąpić niedociśnienie ortostatyczne.
Niektórzy pacjenci nie tolerują inhibitorów ACE z powodu uporczywego kaszlu, który występuje u około 5% do 10% pacjentów rasy kaukaskiej i do 50% pacjentów rasy chińskiej.16 Blokery receptora angiotensyny (ARBs) są uznaną alternatywą.17 Dwa ARBs (kandesartan i walsartan) są zalecane w leczeniu niewydolności serca na podstawie dowodów z kontrolowanych badań klinicznych.17,18 Leki te wykazały zmniejszenie liczby hospitalizacji, a kandesartan, stosowany jako alternatywa dla ACE-I, zmniejszył śmiertelność. Dodatkowo, u pacjentów z dowodami dysfunkcji lewej komory po zawale serca, walsartan zapewniał korzyść nie gorszą niż inhibitory ACE.17
Podawanie beta-blokerów rozpoczynano od bardzo małych dawek i stopniowo zwiększano w miarę tolerancji. Należy ściśle monitorować pacjentów pod kątem objawów niedociśnienia tętniczego, znacznego przyrostu masy ciała, zatrzymania płynów, bradykardii i bloku serca. Ponadto należy poinformować pacjentów, że po rozpoczęciu stosowania beta-blokerów może u nich wystąpić uogólnione zmęczenie lub osłabienie. U pacjentów z chorobą nowotworową trudno jest odróżnić zmęczenie spowodowane chorobą od działań niepożądanych terapii. Zmęczenie związane z terapią beta-blokerami zwykle ustępuje samoistnie w ciągu kilku dni. Należy dołożyć wszelkich starań, aby uzyskać optymalną docelową dawkę beta-adrenolityku.
Antagonista aldosteronu, taki jak spironolakton lub eplerenon, podawany w dawce dobowej 12,5-25 mg jako uzupełnienie standardowej terapii, skutecznie blokuje działanie aldosteronu (badanie RALES), uzyskując kompleksową blokadę neurohormonalną.19 Podczas przepisywania antagonisty aldosteronu, zwłaszcza w połączeniu z inhibitorami ACE i diuretykami pętlowymi, ważne jest monitorowanie stężenia potasu w surowicy, ponieważ takie połączenie może prowadzić do hiperkaliemii.
 kliknij aby powiększyć
kliknij aby powiększyć
click for large version
Programy zarządzania chorobą
Kompleksowe leczenie niewydolności serca nie ogranicza się jedynie do opieki szpitalnej podczas epizodu ADHF. Aby zapobiec powtarzającym się hospitalizacjom, należy wdrożyć dodatkowe środki poprzez formalne programy zarządzania chorobą. Te programy zarządzania chorobą są często kierowane lub koordynowane przez pielęgniarki prowadzące zaawansowane praktyki, które zajmują się kompleksową opieką nad pacjentami z niewydolnością serca, kładąc nacisk na edukację pacjentów i doradztwo w celu poprawy przestrzegania zaleceń.20
Strategie leczenia niefarmakologicznego, na które kładzie się nacisk w programach zarządzania chorobą, okazały się skuteczne w osiąganiu pozytywnych wyników. Obejmują one poradnictwo w zakresie diety, w tym zachęcanie do stosowania dwugramowej diety sodowej, ograniczenie spożywania alkoholu i odpowiednie uzupełnianie strat elektrolitów w wyniku stosowania leków moczopędnych. Prowadzenie dzienniczka dobowej masy ciała pacjenta w domu i przynoszenie go na wizyty w gabinecie pomoże zarówno pacjentowi, jak i lekarzowi skutecznie monitorować retencję płynów.
Nadciśnienie tętnicze jest częstym efektem ubocznym farmakologicznego leczenia niewydolności serca. W celu uniknięcia niepotrzebnego odstawienia leków należy przeprowadzić kompleksową edukację zarówno pacjenta, jak i jego rodziny. Skurczowe ciśnienie krwi 90 mm Hg jest akceptowalne, o ile nie ma towarzyszących objawów zawrotów głowy lub omdleń.
Zachęcaj do aktywności fizycznej, w tym udziału w programach ćwiczeń. Uczestnictwo w spotkaniach grupy wsparcia zapewni pacjentom miejsce, w którym będą mogli dzielić się wspólnymi problemami i obawami z innymi osobami w podobnej sytuacji. Po upływie jednego do dwóch tygodni od wypisu ze szpitala należy zaplanować wizytę kontrolną w poradni niewydolności serca, w trakcie której zostanie wzmocniona edukacja w zakresie niewydolności serca, aby zapobiec kolejnemu epizodowi przyjęcia ADHF.
Podsumowanie
Mimo dodatkowych wyzwań, leczenie ADHF u pacjenta z poważną chorobą współistniejącą, taką jak nowotwór, obejmuje te same cele, co leczenie ADHF u każdego innego pacjenta. Dzięki szybkiej ocenie i odpowiedniej interwencji chory ma największe szanse na przeżycie. TH
Autorzy pracują w University of Texas M.D. Anderson Cancer Center, Department of Cardiology, Houston.
- American Heart Association. Heart Disease and Stroke Statistics-2005 Update. Dallas, Texas..: American Heart Association; 2005. Dostępne pod adresem: www.americanheart.org/downloadable/heart/1105390918119HDSStats2005Update.pdf. Ostatni dostęp 20 sierpnia 2006.
- Koelling TM, Chen RS, Lubwama RN, et al. The expanding national burden of heart failure in the United States: the influence of heart failure in women. Am Heart J. 2004 Jan;147(1):74-78.
- Hunt SA, Abraham WT, Chin MH, et al. ACC/AHA 2005 Guideline Update for the Diagnosis and Management of Chronic Heart Failure in the Adult: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure): developed in collaboration with the American College of Chest Physicians and the International Society for Heart and Lung Transplantation: endorsed by the Heart Rhythm Society. Circulation. 2005 Sep 20;112(12):e154-235.Epub 2005 Sep 13.
- Peacock WF IV, Emerman CL, Wynne J, for the ADHERE Scientific Advisory Committee and Investigators and the ADHERE Study Group. Early use of nesiritide in the emergency department is associated with improved outcome: an ADHERE registry analysis. Ann Emerg Med. 2004;44:S78.
- Stevenson LW. Tailored therapy to hemodynamic goals for advanced heart failure. Eur J Heart Fail. 1999 Aug;1(3):251-257.
- Stevenson LW, Perloff JK. The limited reliability of physical signs for estimating hemodynamics in chronic heart failure. JAMA. 1989;261:884-888.
- Nakagawa O, Ogawa Y, Itoh H, et al. Rapid transcriptional activation and early mRNA turnover of brain natriuretic peptide in cardiocyte hypertrophy. Evidence for brain natriuretic peptide as an „emergency” cardiac hormone against ventricular overload. J Clin Invest. 1995 Sep;96(3):1280-1287.
- Maeda K, Tsutamoto T, Wada A, et al. Plasma brain natriuretic peptide as a biochemical marker of high left ventricular end-diastolic pressure in patients with symptomatic left ventricular dysfunction. Am Heart J. 1998;135(5 Pt 1):825-832.
- Burger AJ. A review of the renal and neurohormonal effects of B-type natriuretic peptide. Congest Heart Fail. 2005 Jan-Feb;11(1):30-38.
- McCullough PA, Nowak RM, McCord J, et al. B-type natriuretic peptide and clinical judgment in emergency diagnosis of heart failure: analysis from Breathing Not Properly (BNP) Multinational Study. Circulation. 2002 Jul;106(4):416-422.
- Maisel AS, Krishnaswamy P, Nowak RM, et al. Rapid measurement of B-type natriuretic peptide in the emergency diagnosis of heart failure. N Engl J Med. 2002 Jul 18;347(3):161-167.
- Adams KF, Lindenfeld J, Arnold JMO, et al. Executive Summary: HFSA 2006 Comprehensive Heart Failure Practice Guideline. J Card Fail. 2006 Feb;12(1):10-38.
- Dec GW. Acute decompensated heart failure: the shrinking role of inotropic therapy. J Am Coll Cardiol. 2005 Jul;46(1):65-67.
- Abraham WT, Adams KF, Fonarow GC, et al. In-hospital mortality in patients with acute decompensated heart failure requiring intravenous vasoactive medications: an analysis from the Acute Decompensated Heart Failure National Registry (ADHERE). J Am Coll Cardiol. 2005 Jul;46(1):57-64.
- Burger AJ, Horton DP, LeJemtel T, et al. Effect of nesiritide (B-type natriuretic peptide) and dobutamine on ventricular arrhythmias in the treatment of patients with acutely decompensated congestive heart failure: the PRECEDENT study. Am Heart J. 2002 Dec;144(6):1102-1108.
- Woo KS, Nicholls MG. High prevalence of persistent cough with angiotensin converting enzyme inhibitors in Chinese. Br J Clin Pharmacol. 1995 Aug;40(2):141-144.
- Pfeffer MA, McMurray JJ, Velazquez EJ, et al. Valsartan, captopril, or both in myocardial infarction complicated by heart failure, left ventricular dysfunction, or both. N Engl J Med. 2003 Nov 13;349(20):1893-1906. Epub 2003 Nov 10.
- Granger CB, McMurray JJ, Yusuf S, et al. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function intolerant to angiotensin-converting-enzyme inhibitors: the CHARM-Alternative trial. Lancet. 2003 Sep 6;362(9386):772-776.
- Pitt B, Zannad F, Remme WJ, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med. 1999 Sep 2;341(10):709-717.
- Albert NM, Eastwood CA, Edwards ML. Evidence-based practice for acute decompensated heart failure. Crit Care Nurse. 2004 Dec;24(6):14-16, 18-24, 26-29; quiz 30-31.
.