W uproszczeniu przeciwciała pełnią dwie główne funkcje w różnych regionach swojej struktury. Podczas gdy jedna część przeciwciała, fragment wiążący antygen (Fab), rozpoznaje antygen, druga część przeciwciała, znana jako fragment krystalizujący (Fc), wchodzi w interakcje z innymi elementami układu odpornościowego, takimi jak fagocyty lub składniki szlaku dopełniacza, aby promować usuwanie antygenu.
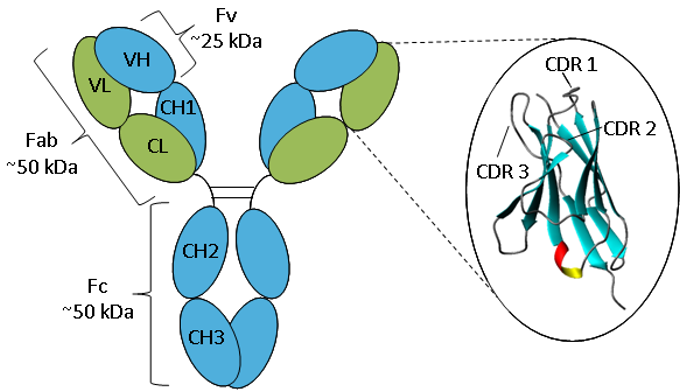
Rycina. Schematyczne przedstawienie IgG.
Przeciwciało składa się z dwóch łańcuchów ciężkich (niebieski) i dwóch łańcuchów lekkich (zielony) złożonych w domeny stałe i zmienne. Powiększenie domeny zmiennej pokazuje wstęgową reprezentację szkieletu β-arkusza i pętli CDR.
Przeciwciała mają tę samą podstawową strukturę składającą się z dwóch ciężkich i dwóch lekkich łańcuchów tworzących dwa ramiona Fab zawierające identyczne domeny na obu końcach, dołączone przez elastyczny region zawiasu do trzonu przeciwciała, domeny Fc, dając klasyczny kształt „Y”. Łańcuchy składają się w powtarzające się fałdy immunoglobulinowe składające się z antyrównoległych arkuszy β (1), które tworzą albo stałe albo zmienne domeny. Domeny Fab składają się z dwóch domen zmiennych i dwóch stałych, przy czym dwie domeny zmienne tworzą fragment zmienny (Fv), który zapewnia swoistość antygenową przeciwciała (2), a domeny stałe działają jako szkielet strukturalny. Każda domena zmienna zawiera trzy hiperzmienne pętle, znane jako regiony determinujące komplementarność (CDR), równomiernie rozmieszczone pomiędzy czterema mniej zmiennymi regionami ramowymi (FR). To właśnie CDR-y zapewniają specyficzne miejsce rozpoznawania antygenu na powierzchni przeciwciała, a hiperzmienność tych regionów umożliwia przeciwciałom rozpoznawanie niemal nieograniczonej liczby antygenów (3).
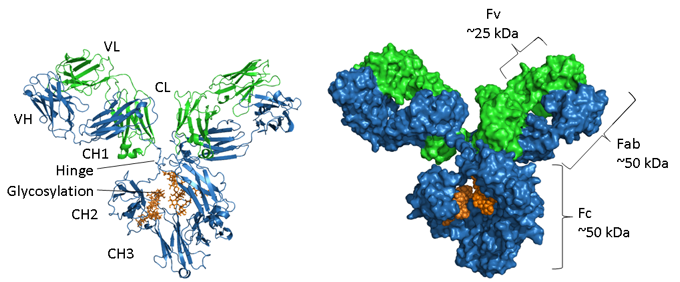
Rysunek. Strukturalne reprezentacje IgG.
Łańcuch ciężki jest pokazany na niebiesko, łańcuch lekki na zielono, a glikozylacja na pomarańczowo. Po lewej stronie znajduje się reprezentacja wstęgowa pokazująca elementy struktury drugorzędowej, a po prawej wypełniony przestrzenią model tej samej cząsteczki. Numer akcesyjny PDB mysiej IgG1 to 1IGY.
Przeciwciała są białkami glikozylowanymi, przy czym pozycja i zakres glikozylacji różnią się w zależności od izotypu. Jak pokazano na powyższym rysunku, region Fc w IgG składa się z dwóch sparowanych domen CH3 i, w przeciwieństwie do nich, dwóch domen CH2, które są oddzielone i nie oddziałują ze sobą, ale mają dwa łańcuchy oligosacharydowe umieszczone między nimi. Łańcuchy te zakrywają hydrofobowe powierzchnie, które normalnie prowadziłyby do łączenia się domen w pary. N-glikany zawierają wspólny region rdzeniowy złożony z dwóch reszt N-acetylo-glukozaminy (GlcNAc) połączonych z asparaginą (N297 w ludzkiej IgG1) za pomocą wiązania amidowego i trzech reszt mannozy. Ta struktura rdzeniowa może zawierać dodatkowe cukry końcowe, takie jak mannoza, GlcNac, galaktoza, fukoza i kwas sialowy, co powoduje dużą heterogeniczność (4).
<< Krótka historia przeciwciał Izotypy przeciwciał & Podtypy >>
<< Przegląd przeciwciał >>
- Poljak, R.J., Amzel, L.M., Avey, H.P., Chen, B.L., Phizackerley, R.P., and Saul, F. (1973). Three-dimensional structure of the Fab' fragment of a human immunoglobulin at 2,8-A resolution. Proc. Natl. Acad. Sci. U.S.A. 70, 3305-3310.
- Inbar, D., Hochman, J., and Givol, D. (1972). Localization of antibody-combining sites within the variable portions of heavy and light chains. Proc. Natl. Acad. Sci. U.S.A. 69, 2659-2662.
- Morea, V., Lesk, A.M., and Tramontano, A. (2000). Antibody modeling: implications for engineering and design. Methods 20, 267-279.
- Wright, A., and Morrison, S.L. (1998). Effect of C2-associated carbohydrate structure on Ig effector function: studies with chimeric mouse-human IgG1 antibodies in glycosylation mutants of Chinese hamster ovary cells. J. Immunol. 160, 3393-3402.
.