nazwa zwyczajowa: eastern tiger swallowtail nazwa naukowa: Papilio (Pterourus) glaucus Linnaeus (Insecta: Lepidoptera: Papilionidae)
Wschodnia jaskółka tygrysia Papilio glaucus Linnaeus jest prawdopodobnie najbardziej rozpoznawalnym gatunkiem jaskółki we wschodnich Stanach Zjednoczonych. Jest on podziwiany przez ogrodników i ceniony przez młodych kolekcjonerów motyli. Pierwszy rysunek jaskółki północnoamerykańskiej przedstawiający samca jaskółki tygrysiej został wykonany w 1587 roku przez Johna White’a, który był dowódcą trzeciej ekspedycji Sir Waltera Raleigha do Ameryki Północnej (Holland 1949, Opler i Krizek 1984). O popularności jaskółki tygrysiej świadczy jej wykorzystanie na dwóch znaczkach pocztowych Stanów Zjednoczonych (Ryc. 1).
Figura 1. U.S. postage stamps featuring eastern tiger swallowtails, Papilio glaucus Linnaeus.
Nomenklatura (Back to Top)
Linnaeus zgrupował niektóre jaskółki i inne motyle pod nazwą rodzajową Papilio (Tyler 1975). Papilio to łacińskie słowo oznaczające motyla. Nazwa podrodzaju Pterourus pochodzi od greckich korzeni „ptero” oznaczającego skrzydło i „ura” oznaczającego ogon (Borror 1960).
Nie ma zgody co do klasyfikacji rodzajowej jaskółek (Hancock 1983, Miller 1987). Niektórzy autorzy (np. Tyler et al. 1994, Minno et al. 2005) stosują system, który podnosi podrodzaj Pterourus do rangi rodzaju, zaproponowany przez Hancocka (1983). Ponieważ nazwa Papilio jest nadal tak powszechnie używana w ogólnodostępnych źródłach, ze względów praktycznych będzie ona używana tutaj zamiast Pterourus.
Rozmieszczenie (Back to Top)
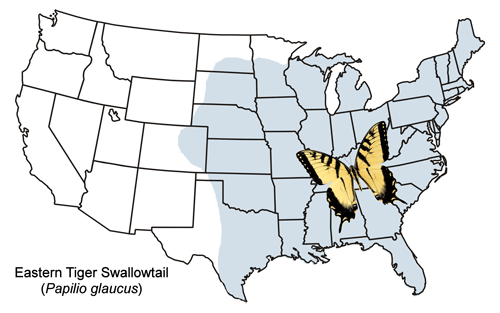
Wschodni ogon tygrysi jest szeroko rozpowszechniony od Nowej Anglii na zachód przez południowy obszar Wielkich Jezior i większość stanów Wielkich Równin (z kilkoma rekordami z Kolorado) i na południe do Teksasu i Florydy (Ryc. 2). W północnych Stanach Zjednoczonych i południowej Kanadzie wschodni jaskółczy ogon tygrysi jest sympatryczny (występuje na tym samym obszarze geograficznym) z blisko spokrewnionym kanadyjskim jaskółczym ogonem, Papilio canadensis, który był kiedyś uważany za podgatunek Papilio glaucus (np. Emmel 1975, Scott 1986). W obrębie tej symplicznej strefy występują pewne hybrydy (Hagen et al. 1991).
Figura 2. Mapa rozmieszczenia Papilio glaucus Linnaeus.
Opis (Back to Top)
Dorosłe: Eastern tiger swallowtail jest dużym gatunkiem z zakresem rozpiętości skrzydeł od 7,9 do 14,0 cm (ok. 3,12 do 5,5 cala) (Pyle 1981). Dorosłe osobniki są żółte z czterema czarnymi pasami na przednich skrzydłach (rys. 3 i 4). Najbardziej wewnętrzny pas pokrywa się z pasem środkowym skrzydła tylnego. Brzegi skrzydeł są czarne z rzędem żółtych plamek.
Ryc. 3. Dorosły jaskółka tygrysia, Papilio glaucus Linnaeus (skrzydła rozpostarte, pokazana powierzchnia grzbietowa). Fotografia autorstwa Donalda W. Halla, Uniwersytet Floryda.
Rysunek 4. Dorosły jaskółka tygrysia, Papilio glaucus Linnaeus (skrzydła złożone, pokazujące powierzchnię brzuszną). Fotografia autorstwa Donalda W. Halla, University of Florida.
Niektóre samice jaskółki tygrysiej są ciemno ubarwione z brzegowym rzędem żółtych plamek (ryc. 5). Na spodniej stronie przednich skrzydeł ciemnej formy widoczne są słabe pozostałości typowych pasków jaskółki tygrysiej (Rysunek 6). Tylne skrzydła formy ciemnej są powyżej pudrowo niebieskie z falistym czarnym pasem oddzielającym pudrowo niebieskie obszary. Pas ten jest nieobecny u samic jaskółki brzegówki, Papilio troilus L., które w innych przypadkach mogą powierzchownie przypominać ciemne jaskółki tygrysie. Ponadto plamki brzeżne Papilio troilus są zwykle niebiesko-zielone, a nie żółte.
W motylach chromosomy płciowe są przeciwieństwem tych u ssaków. Samice motyli są płci heterogametycznej (XY), a samce są homogametyczne (XX). Żółte samice Papilio glaucus rodzą żółte samice, a ciemne samice rodzą ciemne samice, co wskazuje, że gen dla koloru znajduje się na chromosomie Y (Scriber et al.1995).
Ryc. 5. Ciemna samica jaskółki tygrysiej, Papilio glaucus Linnaeus (skrzydła rozpostarte, pokazana powierzchnia grzbietowa). Photograph by Donald W. Hall, University of Florida.
Rysunek 6. Ciemna samica jaskółki tygrysiej, Papilio glaucus Linnaeus (skrzydła złożone, ukazujące powierzchnię brzuszną z charakterystycznymi paskami). Fot. Donald W. Hall, University of Florida.
Ciemne samice są uważane za batesowskie (jadalne) naśladowczynie trującego jaskółki dymówki, Battus philenor (L.). (http://entnemdept.ufl.edu/creatures/bfly/pipevine_swallowtail.htm) (Brower 1958).
Jajka: Jaja są zielone (Minno i Minno 1999).
Larwy: W pełni rozwinięte larwy osiągają do 6,4 cm (ok. 2,5 cala) długości (Minno et al. 2005). Pierwsze trzy stadia są ciemnobrązowe z białym siodłem i przypominają ptasie odchody (Minno i Minno 1999, Wagner 2005). Larwy czwartego i piątego stadium są zielone, z obrzękniętym tułowiem i poprzecznym pasem słabo zaznaczonych niebieskich kropek na każdym segmencie brzusznym (ryc. 7 i 8). Pomiędzy pierwszym a drugim segmentem brzusznym znajduje się czarna poprzeczna pręga z żółtym obrzeżeniem, która zwykle ukryta jest w fałdzie segmentalnym. Larwy posiadają również pojedynczą parę fałszywych gałek ocznych na śródtułowiu. Gałki oczne są żółte z czarną obwódką i zawierają mniejszą niebieską plamkę pokrytą czarną obwódką oraz czarną linię mezad (w kierunku linii środkowej grzbietu) niebieskiej plamki. Osmeterium jest pomarańczowe (Minno et al. 2005). Larwy czwartego stadium zachowują białe siodełko (Ryc. 7).
Ryc. 7. Larwa czwartego stadium jaskółki tygrysiej, Papilio glaucus Linnaeus z białym siodłem. Photograph by Donald W. Hall, University of Florida.
Figura 8. Larwa ostatniego stadium jaskółki tygrysiej, Papilio glaucus Linnaeus. Zdjęcie autorstwa Jerry F. Butler, University of Florida.
Pupae: Poczwarki są tan z ciemnobrązowym lub czarnym pasem bocznym i brązowym pasem grzbietowym (rysunek 9).
Figura 9. Poczwarka jaskółki tygrysiej, Papilio glaucus Linnaeus. Fot. Jerry F. Butler, University of Florida.
Cykl życiowy (Back to Top)
W północnej części zasięgu występują dwa przeloty, a na Florydzie co najmniej trzy i prawdopodobnie cztery (Scriber 1996). Pierwszy lot na Florydzie rozpoczyna się pod koniec lutego lub na początku marca. Dorośli szukają nektaru w różnych kwiatach. Spożywają również wodę i minerały z błota (Berger i Lederhouse 1985). Samce często patrolują na poziomie wierzchołków drzew i zlatują na niższe poziomy, aby przechwycić samice do godów.
Jajeczka składane są pojedynczo i zwykle na górnej powierzchni liści. Świeżo wyklute larwy często zjadają skorupki jaj (Scriber 1996). W jajach Lepidoptera niewielka ilość żółtka pozostaje uwięziona pomiędzy dwiema błonami embrionalnymi (owodniową i surowiczą), które pozostają wewnątrz skorupek jaj po wykluciu. Resztki żółtka służą larwie jako pierwszy posiłek (Imms 1957). Takie zachowanie może również ograniczać wykrywalność przez drapieżniki (Lederhouse 1990), które mogą być przyciągane przez pustą skorupę jaja.
Larwy przędą na liściu matę jedwabiu, która powoduje zwijanie się brzegów liścia do góry, ale nie wytwarzają kompletnego rulonu. Larwa spoczywa na macie jedwabiu. Larwy w średnim i późnym stadium przenoszą się z miejsca spoczynku do innych części rośliny w celu pobierania pokarmu i z powrotem na matę jedwabiu, aby odpocząć (Scriber 1996).
Zgryzione liście są obcinane na ogonkach liściowych i zrzucane z rośliny, prawdopodobnie w celu zmniejszenia przyciągania parazytoidów, które mogą być przyciągane przez lotne substancje chemiczne pochodzące z przeżutych liści lub w celu zmniejszenia drapieżnictwa ptaków, które lokalizują ofiary poprzez wyszukiwanie uszkodzonych liści (Lederhouse 1990, Scriber 1996). Larwy wyrzucają swoje odchody za pomocą żuchwy. Takie zachowanie może również zmniejszyć wykrywalność przez drapieżniki lub parazytoidy (Lederhouse 1990, Scriber et al. 1995).
Po zaprzestaniu żerowania w pełni rozwinięte larwy zmieniają ubarwienie na zielonkawo-brązowe lub czekoladowo-brązowe i wędrują w dół pni drzew, zwykle na ściółkę liściową, gdzie są bardzo kryptyczne. Często przepoczwarczają się na spodniej stronie gałązek lub martwych liściach na ziemi (West i Hazel 1979). Poczwarka jest stadium zimującym (Minno et al. 2005).
Żywiciele (Back to Top)
Wielu gatunków drzew i krzewów z co najmniej siedmiu rodzin jest wykorzystywanych jako żywiciele (Opler i Malikul 1998, Scott 1986). Na półwyspie Floryda, magnolia wirginijska (Magnolia virginiana) jest ulubionym żywicielem i wydaje się być jedynym żywicielem w południowej części półwyspu (Scriber 1986). Słodki zatokowiec rośnie na terenach wilgotnych i można go odróżnić od podobnie wyglądających gatunków Persea (Lauraceae), dzięki bliznom po zgrubieniach, które całkowicie otaczają gałązkę (rysunek 10) oraz szklistym (delikatnym, woskowym, białawym nalotom) spodnim stronom liści Magnolii wirginijskiej (rysunek 11) – cechom, których brak u gatunków Persea. Ponadto, kwiaty, owoce i nasiona Magnolii wirginijskiej są charakterystyczne (Rysunek 11).
Ryc. 10. Pędy magnolii wirginijskiej, Magnolia virginiana (L.) (Magnoliaceae) z bliznami pochewkowymi i podobnie wyglądająca odmiana Persea borbonia, która nie ma blizn pochewkowych. Fot. Donald W. Hall, University of Florida.
Ryc. 11. Magnolia wirginijska (L.) (Magnoliaceae) z charakterystycznym szklistym spodem liścia (wstawka a), kwiatem (wstawka b) i nasionami (strzałka). Zdjęcie Donald W. Hall, University of Florida.
Tulipanowiec, Liriodendron tulipifera Linnaeus (Magnoliaceae) (Rysunek 12), czeremcha zwyczajna, Prunus serotina Ehrh. (Rosaceae) (rysunek 13), jesion wyniosły, Fraxinus americana Linnaeus (Oleaceae) (rysunek 14) i jesion wyniosły, Fraxinus caroliniana Mill. (Oleaceae), są czasami stosowane na północnej Florydzie (Minno i Minno 1999). Fotografie Fraxinus caroliniana można znaleźć na stronie poświęconej temu gatunkowi w Atlasie roślin Florydy (Wunderlin et al. 2019). Drzewa jesionowe można odróżnić od bardzo podobnych hikor (gatunki Carya) przez przeciwne ułożenie ich liści na pniach w porównaniu z naprzemiennym ułożeniem liści hikory.
Rysunek 12. Drzewo tulipanowe, Liriodendron tulipifera L. (Magnoliaceae). Fot. Donald W. Hall, University of Florida.
Ryc. 13. Wiśnia czarna, Prunus serotina Ehrh., liście i kwiaty. Fot. Jerry F. Butler, University of Florida.
Figura 14. Jesion wyniosły, Fraxinus americana Linnaeus (Oleaceae). Photograph by Donald W. Hall, University of Florida.
Wybrane referencje (Back to Top)
- Berger TA, Lederhouse RC. 1985. Puddling by single male and female tiger swallowtails, Papilio glaucus L. (Papilionidae). Journal of the Lepidopterists' Society 39: 339-340.
- Borror DJ. 1960. Dictionary of Word Roots and Combining Forms: Compiled from the Greek, Latin, and other Languages, with Special Reference to Biological and Scientific Names. Mayfield Publishing Company. Palo Alto, California. 134 pp.
- Brower J. 1958. Eksperymentalne badania mimikry w niektórych północnoamerykańskich motyli: Part II. Battus philenor i Papilio troilus, P. polyxenes i P. glaucus. Evolution 12(2): 123-136.
- Emmel J. 1975. Subfamily Papilioninae. pp. 390-402. In: Howe WH. The Butterflies of North America. Doubleday & Company. Garden City, New York. 633 pp.
- Hagen RH, Lederhouse RC, Bossart JL, Scriber JM. 1991. Papilio canadensis and P. glaucus (Papilionidae) are distinct species. Journal of the Lepidopterists' Society 45(4): 245-258.
- Hancock DL. 1983. Classification of the Papilionidae (Lepidoptera): A phylogenetic approach. Smithersia 2: 1-48.
- Holland WJ. 1949. The Butterfly Book. Doubleday & Company. Garden City, New York. 424 pp. + 77 tabliczek.
- Imms A.D. 1957. A General Textbook of Entomology: Including the Anatomy, Physiology, Development and Classification of Insects. p. 212. Ninth Edition (całkowicie zmienione przez Richards OW, Davies RG). Methuen. London. 886 pp.
- Miller JS. 1987. Phylogenetic studies in the Papilioninae (Lepidoptera: Papilionidae). Bulletin of the American Museum of Natural History 186(4): 365-512.
- Minno M, Butler J, Hall D. 2005. Florida Butterfly Caterpillars i ich roślin żywicielskich. University Press of Florida. Gainesville, Florida. 341 pp.
- Minno MC, Minno M. 1999. Florida Butterfly Gardening. University Press of Florida. Gainesville, Florida. 210 pp.
- Lederhouse RC. 1990. Avoiding the hunt: Primary defenses of lepidopteran caterpillars. pp. 175-189. In Evans DL, Schmidt JO. (eds). Insect Defenses: Adaptive Mechanisms and Strategies of Prey and Predators. State University of New York Press. Albany, Nowy Jork. 482 pp.
- Opler PA, Krizek GO. 1984. Butterflies East of the Great Plains. The Johns Hopkins University Press. Baltimore, Maryland.
- Opler PA, Malikul V. 1998. A Field Guide to Eastern Butterflies. Peterson Field Guides. Houghton Mifflin Company. New York, New York. 486 pp.
- Pyle RM. 1981. The Audubon Society Field Guide to North American Butterflies. Alfred A. Knopf. New York, New York. 916 pp.
- Scott JA. 1986. The Butterflies of North America. Stanford University Press. Stanford, CA.
- Scriber JM. 1986. Pochodzenie regionalnych zdolności żywieniowych w tygrysiej jaskółki motyla: ekologiczne monofagii i Papilio glaucus australis podgatunków na Florydzie. Oecologia 71: 94-103.
- Scriber JM. 1996. Tiger tales: natural history of native North American swallowtails. American Entomologist 42: 19-32.
- Scriber JM, Tsubaki Y, Lederhouse RC, Eds. 1995. Swallowtail Butterflies: Their Ecology and Evolutionary Biology. Scientific Publishers. Gainesville, FL.
- Tyler HA. 1975. The Swallowtail Butterflies of North America. Naturegraph Publishers. Healdsburg, California. 192 pp.
- Tyler HA, Brown KS Jr, Wilson KH. 1994. Swallowtail Butterflies of the Americas. Scientific Publishers. Gainesville, Florida. 376 pp.
- West DA, Hazel WN. 1979. Naturalne miejsca poczęć motyli z rodziny jaskółkowatych (Lepidoptera: Papilionidae): Papilio polyxenes Fabr., P. glaucus L. i Battus philenor (L.). Ecological Entomology 4: 387-392.
- Wagner DL. 2005. Caterpillars of Eastern North America. Princeton University Press. Princeton, New Jersey. 512 pp.
- Wunderlin RP, Hansen BF, Franck AR, Essig FB. 2019. Atlas of Florida Plants. Institute for Systematic Botany. University of South Florida. Tampa, Florida. (http://www.florida.plantatlas.usf.edu/) (Dostęp 19 marca 2020)
.