Introduction
Paraliż okresowy jest rodzajem miopatii związanej z metabolizmem jonów potasu (K+), która klinicznie charakteryzuje się nawracającą miastenią ze zmianami poziomu jonów potasu w surowicy (1). Hipokaliemiczne porażenie okresowe (HOPP) jest najczęstszą postacią porażenia okresowego, występującą z częstością około 1 na 100 000, częściej u mężczyzn pochodzenia azjatyckiego. HOPP można podzielić na dwa typy: pierwotny (rodzinny lub idiopatyczny) HOPP i wtórny (nabyty) HOPP (2). Pierwotna HOPP jest spowodowana wewnątrzkomórkowym przesunięciem K+ w wyniku mutacji genu kanału potasowego. Wtórna HOPP jest spowodowana różnymi czynnikami etiologicznymi; jedną z najczęstszych przyczyn jest tyreotoksykoza, która charakteryzuje się zwiększoną aktywnością pompy sodowo-potasowej spowodowaną nadmiarem hormonów tarczycy, co prowadzi do wewnątrzkomórkowego przesunięcia potasu (3). Miopatia niedoczynności tarczycy (HM) jest chorobą mięśni szkieletowych spowodowaną niedoczynnością tarczycy. U około 30% do 80% pacjentów z niedoczynnością tarczycy rozwija się miopatia, której objawy obejmują miastenię, skurcze mięśni po wysiłku, bóle mięśniowe i sztywność mięśni (4). Objawy HM są zwykle łagodne, ale mają tendencję do nasilania się w przypadku nieleczonej ciężkiej niedoczynności tarczycy (5). Uszkodzenie mięśni szkieletowych spowodowane miopatią niedoczynności tarczycy wynika z odkładania się glikozaminoglikanu we włóknach mięśniowych szybkich typu II i wolnych typu I, osłabienia kurczliwości jednostki aktynowo-miozynowej, zmniejszenia aktywności ATPazy miozynowej i spowolnienia obrotu ATP (6). Literatura dotycząca powikłań nerwowo-mięśniowych w niedoczynności tarczycy opiera się w większości na analizie retrospektywnej. Ponadto, ryzyko wystąpienia niedoczynności tarczycy jest większe u pacjentów z dystrofią miotoniczną (7). Dlatego też rzeczywista częstość występowania powikłań nerwowo-mięśniowych w przebiegu niedoczynności tarczycy nie jest łatwa do określenia i może być niedoszacowana. Tak więc rozpoznanie miopatii niedoczynności tarczycy nie jest trudne, jeśli u pacjentów stwierdza się w wywiadzie wyraźną niedoczynność tarczycy (pierwotna niedoczynność tarczycy, wtórna niedoczynność przysadki, autoimmunologiczne zapalenie tarczycy, stan po tyreoidektomii, przepisywanie leków przeciwtarczycowych itp.), lub zmiany mięśniowe rozpoznawane na podstawie typowych objawów klinicznych niedoczynności tarczycy (zespół niskiej podstawowej przemiany materii, twarz obrzękowa, zmiany w układzie sercowo-naczyniowym, układzie pokarmowym itp.) (8). Łatwo jest jednak błędnie zdiagnozować chorych z niedoczynnością tarczycy, jeśli nie mają oni jednoznacznego wywiadu w kierunku choroby tarczycy lub nie mają istotnych objawów hipometabolizmu, ale mają miastenię i mialgię jako główne objawy lub pierwszy objaw (9). Schorzeniem najczęściej mylonym z miopatią niedoczynności tarczycy w klinice jest zapalenie wielomięśniowe (10). Jednakże miopatia niedoczynności tarczycy z porażeniem okresowym jako pierwszym objawem jest rzadko spotykana w klinice i w większości przypadków znana jest jedynie z opisów przypadków. W niniejszej pracy podsumowano dane kliniczne 1 przypadku miopatii niedoczynności tarczycy z porażeniem okresowym jako pierwszym objawem w naszej diagnostyce klinicznej i leczeniu. W badaniu znaleźliśmy również 13 podobnych przypadków zgłoszonych na arenie międzynarodowej i podsumowaliśmy ich charakterystykę kliniczną, diagnostykę i metody leczenia, aby zapewnić odniesienie dla klinicznej diagnostyki i leczenia takich przypadków. Poniższy artykuł przedstawiamy zgodnie z listą kontrolną raportowania CARE (dostępną na stronie http://dx.doi.org/10.21037/apm-20-1578).
Prezentacja przypadku
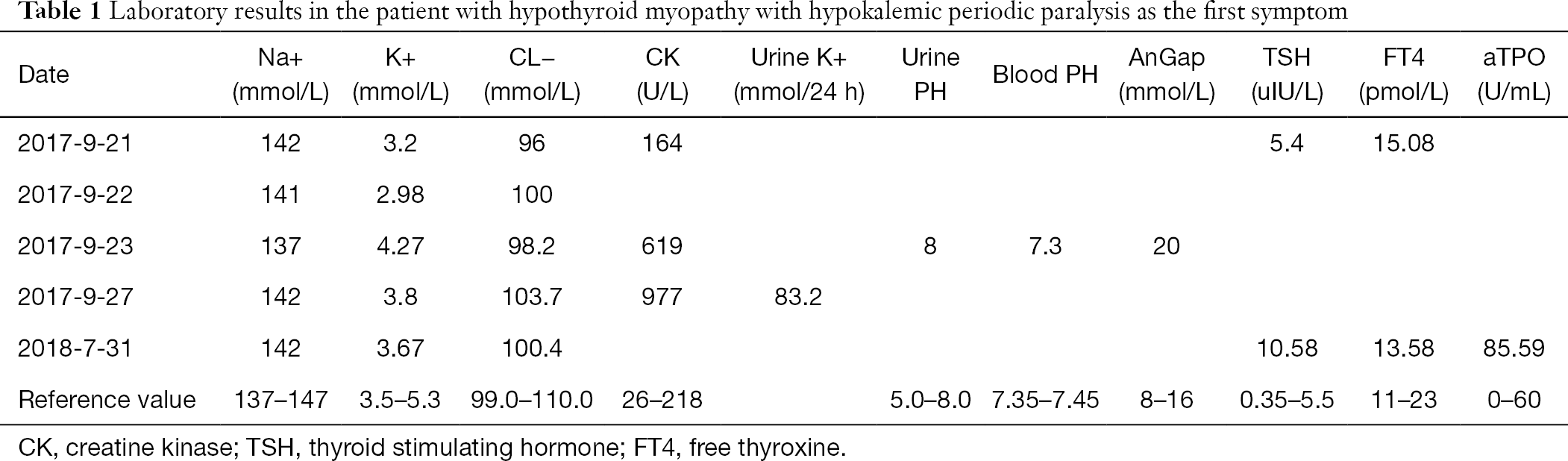
Pacjentem był 27-letni mężczyzna z miasta Tianmen, prowincja Hubei, i został przyjęty 23 września 2017 roku. Począwszy od 8 lat wcześniej, pacjent miał osłabienie kończyn dolnych i trudności w chodzeniu. Badanie w innym szpitalu stwierdziło niski poziom potasu w surowicy, więc pacjent otrzymał suplement potasu do leczenia, z objawami ustępującymi po odpoczynku. W dniu 21 września 2017 roku po wysiłku pacjent ponownie zgłosił się z osłabieniem kończyn dolnych i trudnościami w chodzeniu, ale bez utraty energii, lęku przed zimnem, senności, słabego apetytu, zaparć, przyrostu masy ciała lub innych objawów. W związku z tym pacjentka zgłosiła się do naszego oddziału ratunkowego w celu podjęcia leczenia. Wyniki badania były następujące: stężenie potasu w surowicy 3,2 mmol/l; enzymy mięśniowe, wolna trójjodotyronina (FT3), wolna tyroksyna (FT4) i hormon stymulujący tarczycę (TSH) były prawidłowe. Po dożylnym podaniu asparaginianu potasu oraz doustnym podaniu roztworu chlorku potasu nie uzyskano istotnego złagodzenia objawów. W dniu 22 września stężenie potasu w surowicy wynosiło 2,98 mmol/l, kontynuowano dożylną i doustną suplementację potasu. W nocy 22 września stężenie potasu w surowicy wynosiło 3,64 mmol/l, a chory nadal odczuwał osłabienie kończyn dolnych, w związku z czym został przyjęty z okresowym porażeniem. Pacjent był dotychczas zdrowy, bez nadciśnienia tętniczego, zaburzeń czynności tarczycy i innych chorób. Parametry życiowe były prawidłowe: temperatura ciała 36,2°C, tętno 72/min, ciśnienie tętnicze 120/84 mmHg. Pacjent nie miał widocznego powiększenia tarczycy, ani widocznych nieprawidłowości w sercu, płucach czy jamie brzusznej. Siła mięśniowa i napięcie mięśniowe kończyn górnych były ogólnie prawidłowe, nie stwierdzono wyraźnych zaników i przerostów mięśni kończyn dolnych, nie stwierdzono tkliwości mięśni. Siła mięśniowa była stopnia 4, napięcie mięśniowe obniżone, a odruch kolanowy i odruch ze ścięgna Achillesa osłabione. Wyniki badań laboratoryjnych podczas hospitalizacji, w tym biochemii krwi, biochemii moczu i analizy gazometrycznej krwi, przedstawiono w tabeli 1. Kortyzol i aldosteron we krwi oraz inne badania nie wykazały odchyleń od normy. Elektrokardiogram (EKG) wykazał rytm zatokowy i uniesienie odcinka ST. Badanie radiologiczne klatki piersiowej nie wykazało ewidentnych nieprawidłowości. Kolorowe USG Doppler wykazało stłuszczenie wątroby, a obie nerki i pęcherz moczowy nie wykazały oczywistych nieprawidłowości. Badanie elektromiograficzne (EMG) nie wykazało jednoznacznego uszkodzenia neurogennego ani miogennego. U chorego rozpoznano HOPP i kontynuowano doustną i dożylną suplementację potasu. Stężenie potasu w surowicy w wielokrotnych badaniach było ogólnie prawidłowe, natomiast kinaza kreatynowa (CK) w wielokrotnych badaniach była podwyższona (tab. 1). Po 5 dniach objawy podmiotowe chorego uległy poprawie, a stężenie potasu w surowicy było prawidłowe. Z powodów osobistych odmówił dalszej diagnostyki i leczenia i został wypisany.
Pełna tabela
W dniu 31 lipca 2018 r. u pacjenta ponownie wystąpiło osłabienie z bólem kończyn dolnych po wysiłku. Ambulatoryjne badania biochemiczne krwi i wykrywanie funkcji tarczycy przedstawiono w tabeli 1. Enzymy wątrobowe były podwyższone: aminotransferaza alaninowa (ALT), 81 U/L (wartość referencyjna 0-50 U/L); transaminaza asparaginianowa (AST), 67 U/L (wartość referencyjna 0-50 U/L). Dwanaście pozycji przeciwciał anty-ENA było ujemnych. W kolorowym USG Doppler tarczycy stwierdzono rozlane powiększenie tarczycy i jej obfite ukrwienie. EMG nie wykazało wyraźnego uszkodzenia neurogennego ani miogennego. Na podstawie tych wskaźników u pacjentki rozpoznano autoimmunologiczne zapalenie tarczycy powikłane miopatią niedoczynnościową i podano jej doustnie lewotyroksynę sodową w dawce 25 µg, 1 tabletka/dobę. Po 4 tygodniach pacjentka poinformowała telefonicznie, że osłabienie i bóle mięśniowe kończyn dolnych ustąpiły.
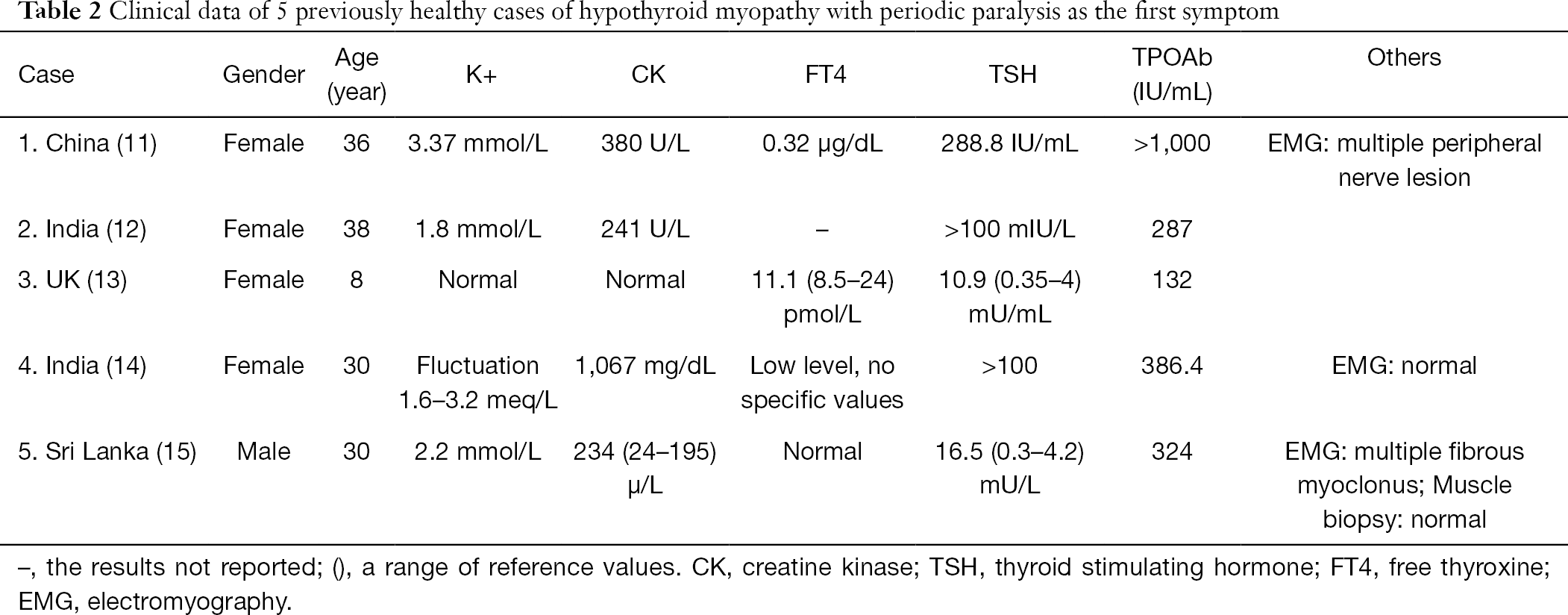
Przeszukaliśmy całą odpowiednią literaturę i znaleźliśmy 13 przypadków z pełną diagnozą kliniczną i raportami dotyczącymi leczenia niedoczynności tarczycy z porażeniem okresowym (Tabela 2). Spośród nich, 5 przypadków z miopatią niedoczynności tarczycy było wcześniej stosunkowo zdrowych, bez chorób tarczycy lub innych chorób podstawowych w wywiadzie. Pierwszym objawem było porażenie okresowe, a jego przebieg wahał się od 2 tygodni do 2 lat. Głównym objawem było osłabienie kończyn, zwłaszcza dolnych, bez zajęcia mięśni oddechowych i zwieraczy. Pozostałe 8 przypadków miopatii niedoczynności tarczycy z porażeniem okresowym było powikłanych innymi stanami klinicznymi (tab. 3). Leczenie wszystkich przypadków podsumowano w części poświęconej dyskusji. Wszystkie procedury wykonywane w badaniach z udziałem ludzi były zgodne ze standardami etycznymi instytucjonalnej i/lub krajowej komisji badawczej (komitetów badawczych) oraz z Deklaracją Helsińską (zrewidowaną w 2013 roku). Pisemną świadomą zgodę uzyskano od pacjenta.
Pełna tabela


Pełna tabela
Dyskusja
Znaleźliśmy łącznie 14 odpowiednich przypadków: 13 przypadków z przeglądu literatury i 1 przypadek z naszego badania. Jedenaście przypadków (78,6%) pochodziło z krajów azjatyckich, z czego 6 (42,9%) z południowoazjatyckich krajów Indii i Sri Lanki, co jest zgodne z charakterystyką epidemiologiczną sporadycznego HOPP, które jest częstsze w populacjach azjatyckich (23). Jednak w tym badaniu stosunek kobiet do mężczyzn wynosił 10:4 (71,43% kobiet i 28,57% mężczyzn), co jest tendencją odwrotną do różnicy płci odnotowanej w częstości występowania pierwotnego HOPP (około 38% u kobiet i 62% u mężczyzn) (24). Może to wynikać z faktu, że choroby pierwotne, takie jak przewlekłe limfocytarne zapalenie tarczycy i niedoczynność tarczycy, występują częściej w populacji kobiet.
Kwasica kanalikowa (RTA) jest przewlekłą kwasicą metaboliczną spowodowaną dystalnym nerkowym wydzielaniem jonów wodorowych i/lub zaburzeniem reabsorpcji wodorowęglanów w kanalikach proksymalnych, której często towarzyszy hipokaliemia oraz zaburzenia gospodarki wapniowo-fosforanowej. Jest również częstą przyczyną HOPP. RTA występuje również w chorobach autoimmunologicznych, takich jak zespół Sjogrena, reumatoidalne zapalenie stawów, toczeń rumieniowaty układowy (SLE) oraz przewlekłe limfocytarne zapalenie tarczycy. Z kolei przewlekłe limfatyczne zapalenie tarczycy jest najczęstszą przyczyną niedoczynności tarczycy, co tłumaczy, dlaczego aż 6 z 14 przypadków niedoczynności tarczycy (42,9%) miało RTA. Poza przypadkami 11 i 13, w których z całą pewnością rozpoznano zespół Sjogrena, RTA w pozostałych przypadkach było prawdopodobnie spowodowane przewlekłym limfocytarnym zapaleniem tarczycy (20,22). Nerkowe wydzielanie H+ zależy od transportu z komórek kanalików dystalnych przez pompę wodorowo-potasową ATP. W stanie niedoczynności tarczycy dochodzi do zmniejszenia liczby i funkcji pompy wodorowo-potasowej ATP, co wiąże się z większym ryzykiem wystąpienia kwasicy i hipokaliemii (25). Wystąpienie HOPP jest bardziej prawdopodobne w połączeniu z innymi czynnikami wpływającymi na równowagę kwasowo-zasadową i wodno-elektrolitową, takimi jak przyjmowanie leków moczopędnych, nadużywanie alkoholu czy cukrzyca (16,18). RTA rozpoznaje się na podstawie objawów klinicznych i niektórych badań pomocniczych. Do objawów klinicznych zalicza się hiperchloremiczną kwasicę metaboliczną z prawidłową luką anionową, PH moczu utrzymujące się >5,5, skłonność do kamicy nerkowej, natomiast do badań pomocniczych test obciążenia chlorkiem sodu i test furosemidowy. We wrześniu 2017 roku podczas wystąpienia porażenia okresowego u naszej pacjentki wystąpiła hipokaliemia z kwasicą (PH krwi tętniczej 7,30), a mocz zasadowicą (PH moczu 8,0). Rozważano możliwość RTA, ale nie potwierdzono jej z powodu prawidłowego stężenia chlorków we krwi i zwiększonej luki anionowej, a pacjentka odmówiła dalszych badań.
Jasne podwyższenie CK występowało u 9 z 14 pacjentów (64,3%), co sugeruje, że jest to częsty objaw miopatii niedoczynności tarczycy. Ponieważ osłabienie mięśni w miopatii niedoczynności tarczycy dotyczy głównie obręczy piersiowej, obręczy miednicznej i mięśni szkieletowych proksymalnych kończyn, które są podobne do miejsc zaangażowanych w zapalenie wielomięśniowe, pacjenci ci są łatwo mylnie diagnozowani jako zapalenie wielomięśniowe. Ponieważ pacjenci z zapaleniem wielomięśniowym często (20-40%) mają dodatnie przeciwciała przeciwjądrowe (ANA) w surowicy, wykrywanie profilu przeciwciał ANA ma ograniczoną wartość w różnicowaniu miopatii niedoczynności tarczycy z SLE i zespołem Sjogrena. EMG i biopsja mięśnia mogą dostarczyć kluczowych informacji dla diagnostyki różnicowej. EMG wykazuje uszkodzenie miogenne w 70-90% przypadków zapalenia wielomięśniowego, podczas gdy EMG nie wykazuje swoistości w miopatii niedoczynności tarczycy, która może być neurogenna, miotoniczna lub prawidłowa. Typowe objawy biopsji mięśni w zapaleniu wielomięśniowym wskazują na martwicę włókien mięśniowych, naciek komórek zapalnych i okołonaczyniowe zaniki mięśni, podczas gdy biopsja mięśni w miopatii niedoczynności tarczycy jest w większości przypadków prawidłowa lub wykazuje niewielkie niecharakterystyczne zmiany patologiczne mięśni. Jednak EMG i biopsja mięśniowa są trudne do zastosowania jako rutynowe badania w klinice z powodu ograniczenia obiektywnych warunków. Dlatego też badanie czynności tarczycy i oznaczenie autoprzeciwciał tarczycowych są ważne w diagnostyce pacjentów z klinicznymi objawami niewyjaśnionego osłabienia mięśni, hipokaliemii i podwyższonego poziomu enzymów mięśniowych. U pacjentów z nawracającym porażeniem okresowym pojedynczy prawidłowy wynik badania czynności tarczycy nie może wykluczyć miopatii niedoczynności tarczycy (jak w opisywanym przypadku). Jeśli u pacjenta wystąpi nawracające osłabienie mięśni, należy w odpowiednim czasie ponownie zbadać czynność tarczycy.
W zakresie leczenia, 13 z 14 pacjentów było leczonych suplementem potasu (dożylnie lub doustnie). W przypadku 3 (13) pacjent miał prawidłowy poziom potasu w surowicy na początku porażenia okresowego, a osłabienie kończyn nie nawróciło po suplementacji tyroksyny. U 13 pacjentów z hipokaliemią czas powrotu stężenia potasu w surowicy do wartości prawidłowych po suplementacji potasu wahał się od godzin do tygodni, przy czym najczęściej wynosił 3-7 dni. W kilku przypadkach (18,20) stężenie potasu w surowicy zmniejszyło się w początkowej fazie suplementacji potasu. W tym stanie chorzy wymagali większej ilości suplementu potasu, a hipokaliemia ustępowała nawet po kilku godzinach od podania potasu w postaci ciągłego dożylnego przetaczania (20). Łącznie u 13 chorych stosowano suplementację egzogenną tyroksyną w dawce 25-150 µg/dobę, a czynność tarczycy samoistnie powróciła do normy w przypadku 6 (16) w 36 dniu od zachorowania (bez suplementacji tyroksyną). Warto zauważyć, że w niektórych przypadkach po rozpoczęciu terapii tyroksyną nie udało się szybko ustąpić hipokaliemii (12, 14), a poziom potasu w surowicy powrócił do normy po kontynuacji suplementacji potasu przez 4 tygodnie po rozpoczęciu doustnej lewotyroksyny. W przypadku 13 po wypisie ze szpitala nadal konieczne było długotrwałe stosowanie doustnego cytrynianu potasu. Przyczyna tej „opóźnionej” korekty hipokaliemii może być związana z efektem diuretycznym i zwiększonym wydalaniem potasu w początkowej fazie podawania tyroksyny (15). Oprócz suplementacji potasu i/lub tyroksyny pacjentom z innymi stanami klinicznymi (tab. 3) podawano również leki alkalizujące, magnezowe, przeciwnadciśnieniowe, hipoglikemizujące, immunosupresyjne, przeciwosteoporotyczne i inne, zgodnie z typem choroby podstawowej. Wszystkie objawy pacjentów zostały opanowane po terminowym leczeniu. Wśród tych pacjentów przypadek 7 przerwał przyjmowanie lewotyroksyny bez zezwolenia 3 tygodnie po początkowym leczeniu i rozwinął bardziej nasilone osłabienie mięśni z hipokaliemią 1 tydzień po odstawieniu leku. Pacjent został ponownie przyjęty do szpitala w celu suplementacji potasu, zasad i tyroksyny, a objawy ustąpiły (17).
Podsumowując, miopatia niedoczynności tarczycy charakteryzująca się okresowym porażeniem jest rzadka w klinice, ale okresowe porażenie może być pierwszym objawem miopatii niedoczynności tarczycy. U pacjentów z nawracającymi porażeniami wiotkimi mięśni szkieletowych zaleca się wykonanie kompleksowego badania laboratoryjnego w kierunku chorób tarczycy w celu wykluczenia zaburzeń czynności tarczycy (nadczynności lub niedoczynności tarczycy), niezależnie od nieprawidłowości poziomu potasu w surowicy lub oczywistych zaburzeń podstawowej przemiany materii. U pacjentów z HOPP i RTA należy zbadać przewlekłe limfocytarne zapalenie tarczycy, a także choroby tkanki łącznej, takie jak zespół Sjogrena i SLE. Korekta nieprawidłowego stężenia potasu w surowicy i suplementacja odpowiedniej ilości tyroksyny może skutecznie kontrolować porażenie okresowe spowodowane niedoczynnością tarczycy. Należy jednak pamiętać, że warunki kliniczne, takie jak moczopędne działanie suplementacji tyroksyną i jednoczesna kwasica, mogą prowadzić do powolnego wzrostu stężenia potasu w surowicy u pacjentów z hipokaliemią. Dlatego też droga, dawka i przebieg suplementacji potasu mogą się różnić u poszczególnych osób.
Podziękowania
Finansowanie: Brak.
Przypisy
Konflikt interesów: Wszyscy autorzy wypełnili jednolity formularz ICMJE dotyczący ujawniania informacji (dostępny na stronie http://dx.doi.org/10.21037/apm-20-1578). Autorzy nie mają konfliktów interesów do zgłoszenia.
Oświadczenie etyczne: Autorzy są odpowiedzialni za wszystkie aspekty pracy w zapewnieniu, że pytania związane z dokładnością lub integralnością jakiejkolwiek części pracy są odpowiednio zbadane i rozwiązane. Wszystkie procedury wykonywane w badaniach z udziałem ludzi były zgodne ze standardami etycznymi instytucjonalnej i/lub krajowej komisji badawczej(-ych) oraz z Deklaracją Helsińską (zrewidowaną w 2013 r.). Pisemna świadoma zgoda została uzyskana od pacjenta.
Oświadczenie o otwartym dostępie: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). Zobacz: https://creativecommons.org/licenses/by-nc-nd/4.0/.
- Akaba Y, Takahashi S, Sasaki Y, et al. Successful treatment of normokalemic periodic paralysis with hydrochlorothiazide. Brain Dev 2018;40:833-6.
- Weber F, Lehmann-Horn F. Hypokalemic periodic paralysis. In: Adam MP, Ardinger HH, Pagon RA, et al., editors. GeneReviews. Seattle (WA): University of Washington, Seattle, 2018:1993-2019.
- Nicoletti T, Modoni A, Silvestri G. Secondary hypokalemic periodic paralysis as a rare clinical presentation of Conn syndrome. Clin Neurophysiol 2018;129:2505-6.
- Lee KW, Kim SH, Kim KJ, et al. A Rare Manifestation of Hypothyroid Myopathy: Hoffmann’s Syndrome. Endocrinol Metab (Seul) 2015;30:626-30.
- Ciompi ML, Zuccotti M, Bazzichi L, Puccetti L. Polymyositis-like syndrome in hypothyroidism: report of two cases. Thyroidology 1994;6:33-6.
- Sindoni A, Rodolico C, Pappalardo MA, et al. Hypothyroid myopathy: A peculiar clinical presentation of thyroid failure. Review of the literature. Rev Endocr Metab Disord 2016;17:499-519.
- Johnson NE, Abbott D, Cannon-Albright LA. Relative risks for comorbidities associated with myotonic dystrophy: a populationbased analysis. Muscle Nerve 2015;52:659-61.
- Aslam H, Sayeed MA, Qadeer R, et al. Hypothyroidism simulating as polymyositis. J Pak Med Assoc 2015;65:559-60.
- Lee KW, Kim SH, Kim KJ, et al. A Rare Manifestation of Hypothyroid Myopathy: Hoffmann’s Syndrome. Endocrinol Metab (Seul) 2015;30:626-30.
- Lin RT, Liu CK, Tai CT, et al. Hypothyroid myopathy-pathological and ultrastructural study. Kaohsiung J Med Sci 2000;16:68-75.
- Jian H, Jingbing C. A case of hypothyroidism with initial symptom of myasthenia was reported. Chinese Journal of Practical Nervous Diseases 2013;16:106-7.
- Chauhan P, Naxane A. Hypothyroidsm with Recurrent Hypokalemic Paralysis. Int J Sci Re 2017;6:2131-2.
- Bandhakavi M. Periodic paralysis as an unusual presentation of autoimmune hypothyroidism with goiter. Clin Pediatr (Phila) 2009;48:677-8.
- Sinha U, Sengupta N, Sinharay K, et al. Recurrent hypokalemic paralysis: An atypical prezentacja niedoczynności tarczycy. Indian J Endocrinol Metab 2013;17:174-6.
- Arambewela MH, Sumanathilaka MR, Pathirana KD, et al. A possible association of hypokalaemic periodic paralysis, autoimmune thyroiditis and neuromyotonia. Ceylon Med J 2013;58:175-6.
- Kanemaru Y, Aizawa K, Kagami T, et al. A case of hypokalemic myopathy associated with transient hypothyroidism. Endocrinol Jpn 1984;31:809-14.
- Meregildo-Rodríguez ED, Failoc-Rojas VE. Case Report: Recurrent hypokalemic periodic paralysis associated with distal renal tubular acidosis (type 1) and hypothyroidism secondary to Hashimoto’s thyroiditis. F1000Res 2018;7:1154.
- Kadeeja N, Senthilnathan N, Viswanathan S, et al. Sporadic hypothyroidism-related hypokalemic paralysis: Diagnosis in a resource-poor setting. J Family Med Prim Care 2017;6:862-4.
- Basak RC, Sharkawi KM, Rahman MM, et al. Distal renal tubular acidosis, hypokalemic paralysis, nephrocalcinosis, primary hypothyroidism, growth retardation, osteomalacia and osteoporosis leading to pathological fracture: a case report. Oman Med J 2011;26:271-4.
- Velarde-Mejía Y, Gamboa-Cárdenas R, Ugarte-Gil M, et al. Hypokalemic Paralysis: A Hidden Card of Several Autoimmune Diseases. Clin Med Insights Arthritis Musculoskelet Disord 2017;10:1179544117722763.
- Naveen L, Malkarnekar S. Adult-Onset Distal Renal Tubular Acidosis with Hypokalemic Quadriparesis in a Patient with Autoimmune Hypothyroidism. J Integr Nephrol Androl 2014;1:82-4.
- Hongmei Z, Weiwei Z, Li Xiaoyong, et al. Approach of the patient with hypokalemia caused Hashimoto’s thyroiditis with primary Sjogren’s syndromeby and renal tubular acidosis. Chin J Endocrinol Metab 2016;32:349-52.
- Luft FC. Nagła hipokaliemia z porażeniem z perspektywy klinicysty. J Mol Med (Berl) 2005;83:167-9.
- Wang W, Jiang L, Ye L, et al. Mutation screening in Chinese hypokalemic periodic paralysis patients. Mol Genet Metab 2006;87:359-63.
- Suzanne M, Martin D, Eddine TA, et al. Hipokaliemia paraliżująca ujawniająca rzadkie skojarzenie chorób autoimmunologicznych: cukrzyca typu 1, zapalenie tarczycy i tubulopatia o przypadku. IOSR Journal of Pharmacy 2015;5:5-7.
(Redaktor języka angielskiego: J. Gray)
.