Ścisła definicja, jonizacja to całkowita utrata elektronu z atomu lub cząsteczki.Powstały w ten sposób gatunek nazywany jest jonem.

W równaniach chemicznych ładunek na jonach jest przedstawiany jako indeks górny, tak jak w tej prostej reakcji jonizacji:
Jony mogą jonizować dalej:
Jony naładowane dodatnio są często określane jako kationy.
Chociaż w ścisłym znaczeniu jonizacja odnosi się do tworzenia jonu dodatniego, w normalnym użyciu słowo to obejmuje również tworzenie jonu ujemnego:
Jony naładowane ujemnie są często określane jako aniony.
Bezpośrednia jonizacja pierwiastków
Metale zazwyczaj tworzą kationy, a niemetale zazwyczaj tworzą aniony.Niektóre pierwiastki, takie jak węgiel, złoto i gazy szlachetne, nie tworzą łatwo jonów.
Metale alkaliczne w grupie 1 układu okresowego i halogenki w grupie 17 jonizują się bardzo łatwo.Metale alkaliczne muszą stracić tylko jeden elektron, aby uzyskać pełną powłokę elektronową: podobnie halogenki muszą zyskać tylko jeden elektron, aby to osiągnąć.Na przykład, sód i chlor reagują spontanicznie poprzez jonizację, tworząc związek jonowy chlorek sodu:
Potas i woda reagują poprzez jonizację, tworząc związek jonowy wodorotlenek potasu plus wodór:
Ionizacja cząsteczek w roztworze
Cząsteczki gazowego chlorowodoru łatwo jonizują się w wodzie, tworząc kwas solny.
Samo-jonizacja
W wodzie istnieje równowaga pomiędzy cząsteczkami wody i jonami wynikającymi z samo-jonizacji wody. (Patrz amfiprotyczny.)
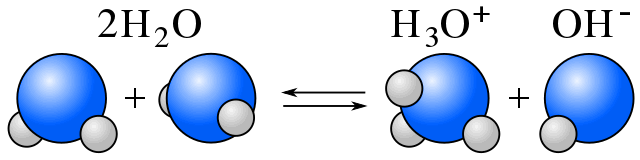
Ionizacja w plazmie
W bardzo wysokich temperaturach elektrony są odrywane od atomów tworząc plazmę.Na przykład, w koronie słonecznej:
Energia potrzebna do usunięcia jednego elektronu z danego gatunku jest jego energią jonizacji.Energia potrzebna do usunięcia drugiego elektronu jest drugą energią jonizacji; do usunięcia trzeciego jest trzecią energią jonizacji, itd.
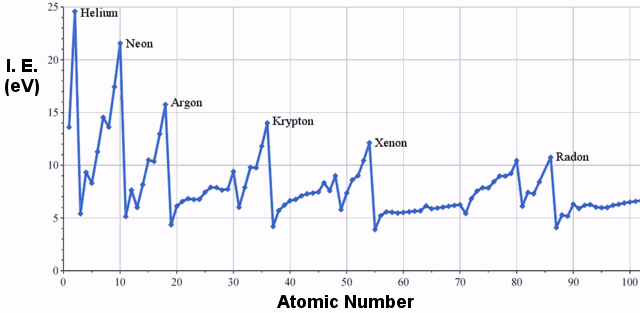
Przykłady energii jonizacji
Pierwsze energie jonizacji pierwiastków w trzecim rzędzie układu okresowego są następujące:
Pierwsza energia jonizacji
| Pierwiastek | Pierwsza energia jonizacji (eV) |
|---|---|
| Sód | 5.14 |
| Magnez | 7.65 |
| Aluminium | 5.99 |
| Krzem | 8.15 |
| Fosfor | 10.49 |
| Siarka | 10.36 |
| Chlor | 12.97 |
| Argon | 15.76 |
Jasno widać, że w układzie okresowym istnieje tendencja do zwiększania energii jonizacji w kierunku od lewej do prawej.Poniższy wykres ilustruje tę tendencję dla szerszego wyboru pierwiastków: