Wskazówki do zdobycia wiedzy
- Zidentyfikuj typy receptorów, ich skład molekularny i różnice między nimi
Receptory są cząsteczkami białkowymi w komórce docelowej lub na jej powierzchni, które wiążą ligand. Istnieją dwa rodzaje receptorów, receptory wewnętrzne i receptory na powierzchni komórki.
Receptory wewnętrzne

Rysunek 1. Hydrofobowe cząsteczki sygnałowe zazwyczaj dyfundują przez błonę plazmatyczną i oddziałują z wewnątrzkomórkowymi receptorami w cytoplazmie. Wiele receptorów wewnątrzkomórkowych to czynniki transkrypcyjne, które oddziałują z DNA w jądrze i regulują ekspresję genów.
Receptory wewnętrzne, znane również jako receptory wewnątrzkomórkowe lub cytoplazmatyczne, znajdują się w cytoplazmie komórki i reagują na hydrofobowe cząsteczki ligandów, które są w stanie przemieszczać się przez błonę plazmatyczną. Po wejściu do komórki wiele z tych cząsteczek wiąże się z białkami, które działają jako regulatory syntezy mRNA (transkrypcji), pośrednicząc w ekspresji genów. Ekspresja genów jest komórkowym procesem przekształcania informacji zawartej w DNA komórki w sekwencję aminokwasów, która ostatecznie tworzy białko. Kiedy ligand zwi±zuje się z wewnętrznym receptorem, dochodzi do zmiany konformacyjnej, która odsłania miejsce wi±ż±ce DNA na białku. Kompleks ligand-receptor przemieszcza się do jądra, a następnie wiąże się ze specyficznymi regionami regulatorowymi chromosomalnego DNA i promuje inicjację transkrypcji (Rysunek 1). Transkrypcja jest procesem kopiowania informacji zawartej w DNA komórki do specjalnej formy RNA zwanej messenger RNA (mRNA); komórka wykorzystuje informacje zawarte w mRNA (które przemieszcza się do cytoplazmy i łączy się z rybosomami), aby połączyć określone aminokwasy w odpowiedniej kolejności, wytwarzając białko. Receptory wewnętrzne mogą bezpośrednio wpływać na ekspresję genów bez konieczności przekazywania sygnału do innych receptorów lub posłańców.
Receptory powierzchniowe
Receptory powierzchniowe, znane również jako receptory transmembranowe, są zakotwiczonymi w błonie (integralnymi) białkami powierzchni komórki, które wiążą się z zewnętrznymi cząsteczkami ligandów. Ten typ receptora rozpościera się na błonie plazmatycznej i dokonuje transdukcji sygnału, w której sygnał zewnątrzkomórkowy jest przekształcany w sygnał międzykomórkowy. Ligandy, które oddziałują z receptorami powierzchniowymi nie muszą wnikać do wnętrza komórki, na którą oddziałują. Receptory powierzchni komórki są również nazywane białkami specyficznymi dla komórek lub markerami, ponieważ są specyficzne dla poszczególnych typów komórek.
Każdy receptor powierzchni komórki ma trzy główne elementy: zewnętrzną domenę wiążącą ligand, hydrofobowy region rozprzestrzeniający się w błonie oraz domenę wewnątrzkomórkową wewnątrz komórki. Domena wiążąca ligand nazywana jest również domeną zewnątrzkomórkową. Rozmiar i zakres każdej z tych domen różni się znacznie w zależności od typu receptora.
Ponieważ białka receptorowe powierzchni komórki mają fundamentalne znaczenie dla normalnego funkcjonowania komórki, nie powinno dziwić, że nieprawidłowe działanie któregokolwiek z tych białek może mieć poważne konsekwencje. Wykazano, że błędy w strukturze białek niektórych cząsteczek receptorowych odgrywają rolę w nadciśnieniu (wysokie ciśnienie krwi), astmie, chorobach serca i nowotworach.
Jak wirusy rozpoznają gospodarza
W przeciwieństwie do żywych komórek, wiele wirusów nie posiada błony plazmatycznej ani żadnej ze struktur niezbędnych do podtrzymania życia. Niektóre wirusy składają się po prostu z obojętnej powłoki białkowej zawierającej DNA lub RNA. Aby się rozmnażać, wirusy muszą wtargnąć do żywej komórki, która służy im jako gospodarz, a następnie przejąć aparat komórkowy gospodarza. Ale w jaki sposób wirus rozpoznaje swojego gospodarza?
Wirusy często wiążą się z receptorami na powierzchni komórki gospodarza. Na przykład wirus wywołujący ludzką grypę (grypa) wiąże się specjalnie z receptorami na błonach komórek układu oddechowego. Różnice chemiczne w receptorach na powierzchni komórek u różnych gospodarzy oznaczają, że wirus, który zakaża określony gatunek (na przykład ludzi), nie może zakażać innego gatunku (na przykład kurcząt).
Jednakże wirusy mają bardzo małe ilości DNA lub RNA w porównaniu z ludźmi, w wyniku czego rozmnażanie wirusów może przebiegać szybko. Reprodukcja wirusów niezmiennie powoduje błędy, które mogą prowadzić do zmian w nowo wyprodukowanych wirusach; zmiany te oznaczają, że białka wirusowe, które oddziałują z receptorami na powierzchni komórki mogą ewoluować w taki sposób, że mogą wiązać się z receptorami w nowym gospodarzu. Takie zmiany zachodzą losowo i dość często w cyklu reprodukcyjnym wirusa, ale mają one znaczenie tylko wtedy, gdy wirus z nowymi właściwościami wiążącymi wejdzie w kontakt z odpowiednim gospodarzem. W przypadku grypy taka sytuacja może mieć miejsce w miejscach, w których zwierzęta i ludzie są w bliskim kontakcie, takich jak fermy drobiu i trzody chlewnej. Gdy wirus przeskoczy do nowego gospodarza, może się szybko rozprzestrzeniać. Naukowcy uważnie obserwują nowo pojawiające się wirusy (zwane wirusami nowo pojawiającymi się) w nadziei, że takie monitorowanie może zmniejszyć prawdopodobieństwo globalnej epidemii wirusowej.
Receptory powierzchni komórki są zaangażowane w większość sygnalizacji w organizmach wielokomórkowych. Istnieją trzy ogólne kategorie receptorów powierzchni komórki: receptory związane z kanałami jonowymi, receptory związane z białkami G oraz receptory związane z enzymami.

Rysunek 2. Kanały jonowe bramkowane tworzą por przez błonę plazmatyczną, który otwiera się po związaniu cząsteczki sygnalizacyjnej. Otwarty por pozwala następnie jonom na przepływ do lub z komórki.
Receptory związane z kanałami jonowymi wiążą ligand i otwierają kanał przez błonę, który pozwala na przejście określonych jonów. Aby utworzyć kanał, ten typ receptora na powierzchni komórki ma rozległy region rozprzestrzeniający się w błonie. Aby oddziaływać z ogonami kwasów tłuszczowych fosfolipidów, które tworzą centrum błony plazmatycznej, wiele aminokwasów w regionie rozprzestrzeniania się błony ma charakter hydrofobowy. I odwrotnie, aminokwasy znajdujące się wewnątrz kanału są hydrofilowe, aby umożliwić przenikanie wody lub jonów. Kiedy ligand wiąże się z zewnątrzkomórkowym regionem kanału, następuje zmiana konformacyjna w strukturze białka, która pozwala na przejście jonów takich jak sód, wapń, magnez i wodór (rysunek 2).
Receptory związane z białkiem G wiążą ligand i aktywują białko błonowe zwane białkiem G. Następnie aktywowane białko G wchodzi w interakcję z białkiem G. Aktywowane białko G wchodzi następnie w interakcję z kanałem jonowym lub enzymem w błonie (rysunek 3). Wszystkie receptory związane z białkiem G mają siedem domen transmembranowych, ale każdy receptor ma swoją specyficzną domenę zewnątrzkomórkową i miejsce wiążące białko G.
Sygnalizacja komórkowa za pomocą receptorów związanych z białkiem G zachodzi jako cykliczna seria zdarzeń. Zanim ligand się zwiąże, nieaktywne białko G może związać się z nowo odkrytym miejscem na receptorze, specyficznym dla jego wiązania. Gdy białko G zwi±zuje się z receptorem, zmiana kształtu powoduje aktywację białka G, które uwalnia GDP i pobiera GTP. Następnie podjednostki białka G rozdzielają się na podjednostkę α i podjednostkę βγ. Jeden lub oba te fragmenty białka G mogą w rezultacie aktywować inne białka. Po pewnym czasie GTP na aktywnej podjednostce α białka G jest hydrolizowane do GDP, a podjednostka βγ ulega dezaktywacji. Podjednostki ponownie się łączą, tworząc nieaktywne białko G i cykl zaczyna się od nowa.
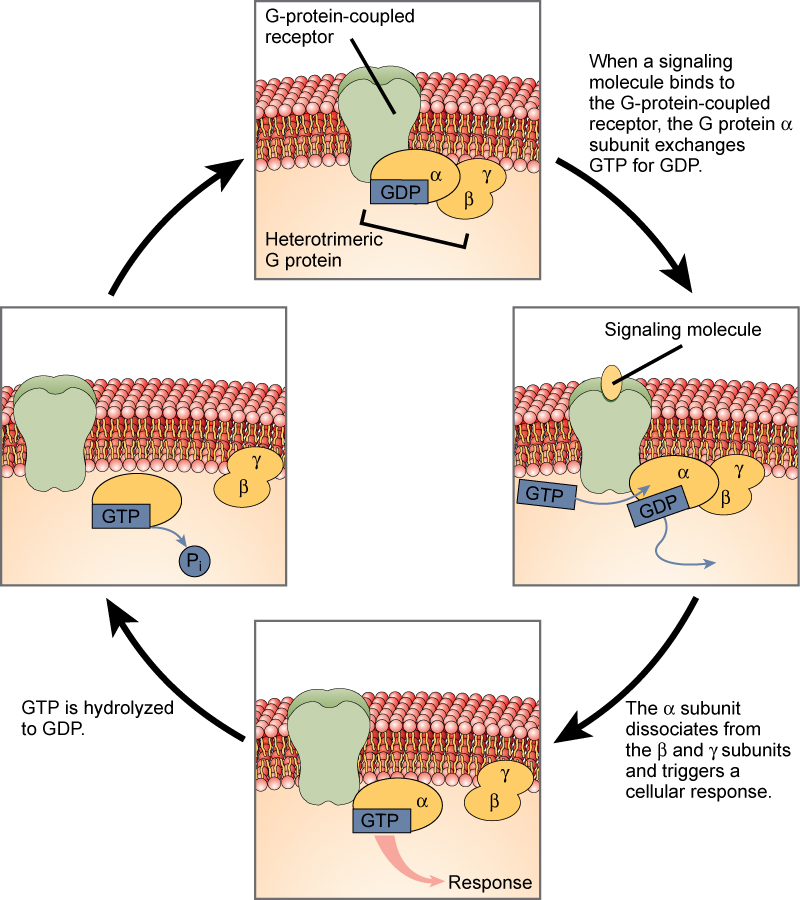
Rys. 3. Heterotrimeryczne białka G mają trzy podjednostki: α, β i γ. Kiedy cząsteczka sygnalizacyjna wiąże się z receptorem sprzężonym z białkiem G w błonie plazmatycznej, cząsteczka GDP związana z podjednostką α jest wymieniana na GTP. Podjednostki β i γ dysocjują od podjednostki α, a odpowiedź komórkowa jest wyzwalana albo przez podjednostkę α, albo przez zdysocjowaną parę βγ. Hydroliza GTP do GDP kończy sygnał.
Receptory związane z białkiem G były szeroko badane i wiele dowiedziano się o ich roli w utrzymaniu zdrowia. Bakterie, które są patogenne dla ludzi, mogą uwalniać trucizny, które przerywają specyficzne funkcje receptorów powiązanych z białkiem G, prowadząc do chorób takich jak krztusiec, botulizm i cholera.

Rysunek 4. Przenoszona głównie przez skażoną wodę pitną, cholera jest główną przyczyną zgonów w krajach rozwijających się oraz na obszarach, gdzie klęski żywiołowe przerywają dostęp do czystej wody. (kredyt: New York City Sanitary Commission)
W cholerze (Rysunek 4), na przykład, bakteria Vibrio cholerae przenoszona przez wodę wytwarza toksynę, choleragen, która wiąże się z komórkami wyściełającymi jelito cienkie. Toksyna następnie wnika do tych komórek jelitowych, gdzie modyfikuje białko G, które kontroluje otwarcie kanału chlorkowego i powoduje, że pozostaje on stale aktywny, co powoduje dużą utratę płynów z organizmu i potencjalnie śmiertelne odwodnienie.
Nowoczesne warunki sanitarne eliminują zagrożenie epidemiami cholery, takimi jak ta, która przetoczyła się przez Nowy Jork w 1866 roku. Ten plakat z tamtej epoki pokazuje, że w tamtym czasie nie rozumiano sposobu przenoszenia choroby.
Receptory związane z enzymami to receptory na powierzchni komórki z domenami wewnątrzkomórkowymi, które są związane z enzymem. W niektórych przypadkach sama domena wewnątrzkomórkowa receptora jest enzymem. Inne receptory związane z enzymami mają małą domenę wewnątrzkomórkową, która oddziałuje bezpośrednio z enzymem. Receptory związane z enzymami mają zwykle duże domeny zewnątrzkomórkowe i wewnątrzkomórkowe, ale region rozprzestrzeniający się przez błonę składa się z pojedynczego regionu alfa-helikalnego łańcucha peptydowego. Kiedy ligand wiąże się z domeną zewnątrzkomórkową, sygnał jest przenoszony przez błonę, aktywując enzym. Aktywacja enzymu uruchamia łańcuch zdarzeń w komórce, który ostatecznie prowadzi do odpowiedzi. Jednym z przykładów tego typu receptora związanego z enzymem jest receptor kinazy tyrozynowej (Rysunek 5). Kinaza jest enzymem, który przenosi grupy fosforanowe z ATP na inne białko. Receptor kinazy tyrozynowej przenosi grupy fosforanowe na cząsteczki tyrozyny (reszty tyrozynowe). Najpierw cząsteczki sygnalizujące wiążą się z zewnątrzkomórkową domeną dwóch pobliskich receptorów kinazy tyrozynowej. Następnie dwa sąsiadujące receptory łączą się, czyli dimeryzują. Następnie do reszt tyrozynowych w domenie wewnątrzkomórkowej receptorów dodawane są fosforany (fosforylacja). Fosforylowane reszty mogą następnie przekazać sygnał do następnego posłańca w cytoplazmie.
Pytanie praktyczne

Rysunek 5. Receptorowa kinaza tyrozynowa jest enzymatycznie związanym receptorem z pojedynczym regionem transmembranowym oraz domeną zewnątrz- i wewnątrzkomórkową. Wiązanie cząsteczki sygnalizacyjnej do domeny zewnątrzkomórkowej powoduje dimeryzację receptora. Rezyty tyrozynowe w domenie wewnątrzkomórkowej ulegają autofosforylacji, wyzwalając odpowiedź komórkową. Sygnał jest zakończony przez fosfatazę, która usuwa fosforany z reszt fosfotyrozynowych.
HER2 jest receptorową kinazą tyrozynową. W 30 procentach ludzkich raków piersi, HER2 jest trwale aktywowany, co powoduje nieuregulowany podział komórek. Lapatynib, lek stosowany w leczeniu raka piersi, hamuje autofosforylację kinazy tyrozynowej receptora HER2 (proces, w którym receptor dodaje do siebie fosforany), zmniejszając w ten sposób wzrost guza o 50 procent. Oprócz autofosforylacji, który z następujących etapów byłby hamowany przez lapatynib?
- Wiązanie cząsteczek sygnałowych, dimeryzacja i odpowiedź komórkowa
- Dimeryzacja, i odpowiedź komórkowa
- Odpowiedź komórkowa
- Aktywność fosfatazy, dimeryzacja i odpowiedź komórkowa
Try It
Przykłady!
Popraw tę stronęDowiedz się więcej