Przewodnictwo
Inną charakterystyczną właściwością związków jonowych jest ich przewodnictwo elektryczne. Poniższy rysunek przedstawia trzy eksperymenty, w których dwie elektrody podłączone do żarówki są umieszczone w zlewkach zawierających trzy różne substancje.
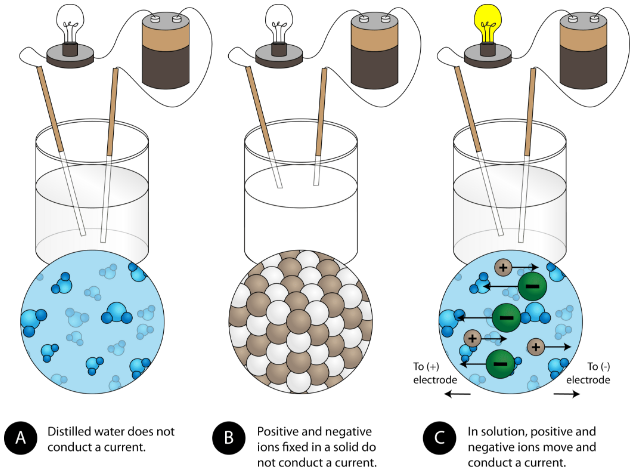
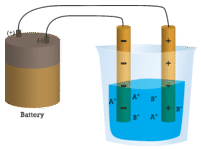
W pierwszej zlewce woda destylowana nie przewodzi prądu, ponieważ woda jest związkiem cząsteczkowym. W drugiej zlewce stały chlorek sodu również nie przewodzi prądu. Pomimo tego, że jest jonowy, a więc składa się z naładowanych cząsteczek, stała sieć krystaliczna nie pozwala jonom na przemieszczanie się pomiędzy elektrodami. Aby obwód był kompletny i żarówka mogła się zaświecić, potrzebne są ruchome naładowane cząsteczki. W trzeciej zlewce, NaCl został rozpuszczony w wodzie destylowanej. Teraz siatka krystaliczna została rozbita i poszczególne jony dodatnie i ujemne mogą się przemieszczać. Kationy przemieszczają się do jednej elektrody, a aniony do drugiej, umożliwiając przepływ prądu (patrz rysunek poniżej). Topienie związku jonowego uwalnia również jony, które mogą przewodzić prąd. Związki jonowe przewodzą prąd elektryczny, gdy są stopione lub rozpuszczone w wodzie. Rozpuszczanie związków jonowych w wodzie zostanie omówione w rozdziale 9.3.
Przykład
Zapisz równanie dysocjacji stałego NaCl w wodzie.
Rozwiązanie
NaCl(s) → Na+(aq) + Cl-(aq)
Ćwiczenie ́(́PageIndex{1}})
Napisz równanie dysocjacji stałego NH4NO3 w wodzie.
Odpowiedź
NH4NO3(s) → NH4+(aq) + NO3-(aq)