Streng gedefinieerd is ionisatie het volledige verlies van een elektron van een atomaire of moleculaire stof. De resulterende stof wordt een ion genoemd.

In chemische vergelijkingen wordt de lading van ionen weergegeven als een superscript, zoals in deze eenvoudige ionisatiereactie:
Ionen kunnen verder ioniseren:
Positief geladen ionen worden vaak kationen genoemd.
Hoewel ionisatie strikt genomen betrekking heeft op de vorming van een positief ion, omvat het woord in het normale gebruik ook de vorming van een negatief ion:
Negatief geladen ionen worden dikwijls anionen genoemd.
Directe ionisatie van elementen
Metalen vormen gewoonlijk kationen en niet-metalen vormen gewoonlijk anionen.Sommige elementen, zoals koolstof, goud en de edelgassen, vormen niet gemakkelijk ionen.
De alkalimetalen in groep 1 van het periodiek systeem en de halogeniden in groep 17 ioniseren zeer gemakkelijk. Alkalimetalen hoeven slechts één elektron te verliezen om een volledige elektronenschil te verkrijgen; evenzo hoeven halogeniden slechts één elektron te winnen om dit te bereiken.Natrium en chloor reageren bijvoorbeeld spontaan door te ioniseren en vormen zo de ionische verbinding natriumchloride:
Kalium en water reageren door te ioniseren en vormen zo de ionische verbinding kaliumhydroxide plus waterstof:
Ionisatie van Moleculen in Oplossing
Waterstofchloridemoleculen ioniseren gemakkelijk in water om zoutzuur te produceren.
Zelf-ionisatie
In water bestaat een evenwicht tussen watermoleculen en ionen die het gevolg zijn van de zelf-ionisatie van water. (Zie amfiprotisch.)
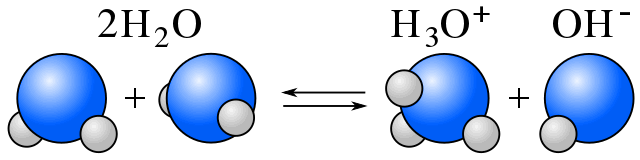
Ionisatie in plasma
Bij zeer hoge temperaturen worden elektronen van atomen gestript, zodat een plasma ontstaat.Bijvoorbeeld in de corona van de zon:
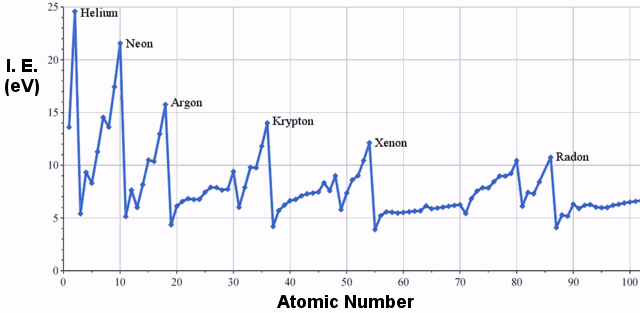
De energie die nodig is om één elektron van een soort te verwijderen is de ionisatie-energie.De energie om een tweede elektron te verwijderen is de tweede ionisatie-energie; om een derde elektron te verwijderen is de derde ionisatie-energie, enz.
Voorbeelden van ionisatie-energie
De eerste ionisatie-energieën van elementen in de derde rij van het periodiek systeem zijn als volgt:
Eerste ionisatie-energie
| Element | Eerste ionisatie-energie (eV) |
|---|---|
| Natrium | 5.14 |
| Magnesium | 7.65 |
| Aluminium | 5.99 |
| Silicium | 8.65 |
| Aluminium | 5.99 |
| 8.15 | |
| Fosfor | 10,49 |
| Zwavel | 10,36 |
| Chloor | 12,97 |
| 15,76 | |
| Chlorine | 12,97 |
| 15.76 |
Het is duidelijk dat er een trend is van toenemende ionisatie-energie van links naar rechts in het periodiek systeem.De onderstaande grafiek illustreert deze trend voor een bredere selectie van elementen: