De Wet van Beer-Lambert (ook wel de Wet van Beer genoemd) is een verband tussen de verzwakking van licht door een stof en de eigenschappen van die stof. In deze blogpost worden eerst de definities van transmissie en absorptie van licht door een stof geïntroduceerd, gevolgd door een uitleg van de Wet van Beer-Lambert.
Wat zijn transmissie en absorptie?
Beschouw monochromatisch licht dat door een oplossing wordt geleid; met een invallende intensiteit van I0 en een doorgelaten intensiteit van I (figuur 1).
De transmissiecoëfficiënt, T, van de oplossing wordt gedefinieerd als de verhouding van de doorgelaten lichtsterkte, I, tot de invallende lichtsterkte, I0:
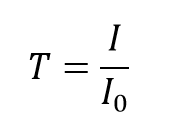
en kan waarden tussen 0 en 1 aannemen. Het wordt echter meestal uitgedrukt als een transmissiepercentage:
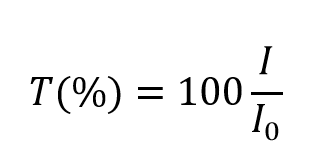
De extinctie, A, van de oplossing is gerelateerd aan de transmissie en de invallende en doorgelaten intensiteit door middel van de volgende relaties:
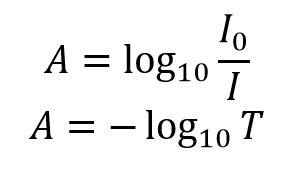
De extinctie heeft een logaritmisch verband met de doorlatendheid; waarbij een extinctie van 0 overeenkomt met een doorlatendheid van 100% en een extinctie van 1 met een doorlatendheid van 10%. Aanvullende waarden van transmissie en absorptie worden gegeven in tabel 1. Een visuele demonstratie van het effect dat de extinctie van een oplossing heeft op de verzwakking van het licht dat er doorheen gaat wordt getoond in figuur 2, waar een 510 nm laser door drie oplossingen van Rhodamine 6G met verschillende extinctie wordt geleid.
Tabel 1: Absorptie- en transmissiewaarden:
| Absorbance | Transmittance |
|---|---|
| 0 | 100% |
| 1 | 10% |
| 2 | 1% |
| 3 | 0.1% |
| 4 | 0,01% |
| 5 | 0.001% |

Figuur 2: Verzwakking van een 510 nm laser door drie oplossingen van Rhodamine 6G met verschillende extinctie waarden bij 510 nm. De gele gloed is de fluorescentie-emissie bij ~560 nm.
Absorbantie is een dimensieloze grootheid en zou daarom eenheidsloos moeten zijn. Het komt echter vaak voor dat na de extinctie eenheden van AU worden vermeld, waarvan men zegt dat ze ofwel staan voor arbitraire eenheden ofwel voor extinctie-eenheden. Deze eenheden zijn overbodig en moeten worden vermeden. Een ander veel voorkomend verschijnsel is het gebruik van de term optische dichtheid of OD in plaats van extinctie. Optische dichtheid is een oudere term die, in de context van absorptiespectroscopie, synoniem is met absorptie; het gebruik van optische dichtheid in plaats van absorptie wordt echter afgeraden door de IUPAC.1
Wat is de wet van Beer-Lambert?
De wet van Beer-Lambert is een lineair verband tussen de extinctie en de concentratie, de molaire extinctiecoëfficiënt en de optische coëfficiënt van een oplossing:

De molaire extinctiecoëfficiënt is een monsterafhankelijke eigenschap en is een maat voor hoe sterk het monster bij een bepaalde golflengte van licht absorbeert. De concentratie is eenvoudigweg het aantal mol L-1 (M) van het monster dat in de oplossing is opgelost, en de lengte is de lengte van de cuvet die voor de extinctiemeting wordt gebruikt en is gewoonlijk 1 cm.
De wet van Beer-Lambert stelt dat er een lineair verband is tussen de concentratie en de extinctie van de oplossing, waardoor de concentratie van een oplossing kan worden berekend door de extinctie ervan te meten. Om deze lineaire afhankelijkheid aan te tonen werden vijf oplossingen van Rhodamine B in water gemeten met de DS5 Dual Beam Spectrofotometer (figuur 3a) en uit deze absorptiespectra werd een lineaire ijkkromme van de extinctie tegen de concentratie gemaakt (figuur 3b). Met behulp van deze ijklijn kan de concentratie van een onbekende Rhodamine B-oplossing worden bepaald door de extinctie te meten, wat het belangrijkste nut van de Wet van Beer-Lambert is.
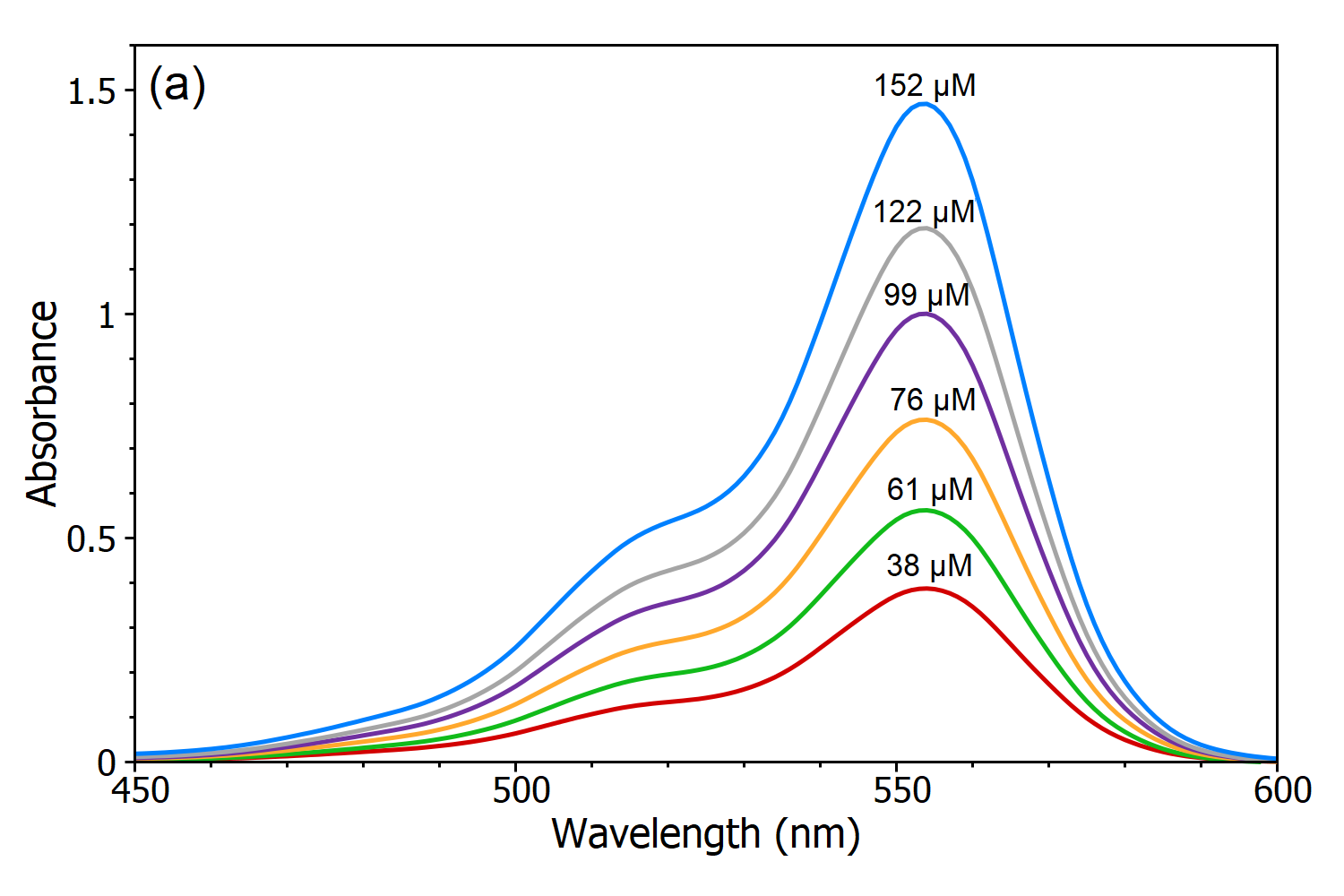

Figuur 3 (a): Absorptiespectra van Rhodamine B-oplossingen met verschillende concentraties in water, gemeten met de DS5 Dual Beam Spectrofotometer. (b) Kalibratiecurve van Rhodamine B in het water gemeten bij λmax.
Voor meer informatie over de theorie van absorptiespectroscopie, zie de sectie veelgestelde vragen op onze blog.