Dit zijn aantekeningen uit college 11 van de cursus Celbiologie van Harvard Extension.
Dit college behandelt twee verschillende manieren waarop cellen kunnen afsterven: apoptose (geprogrammeerde celdood) en necrose (ongeplande celdood). Onder de microscoop zijn deze twee morfologisch gemakkelijk uit elkaar te houden, zoals te zien is in deze afbeelding van Wikimedia Commons:
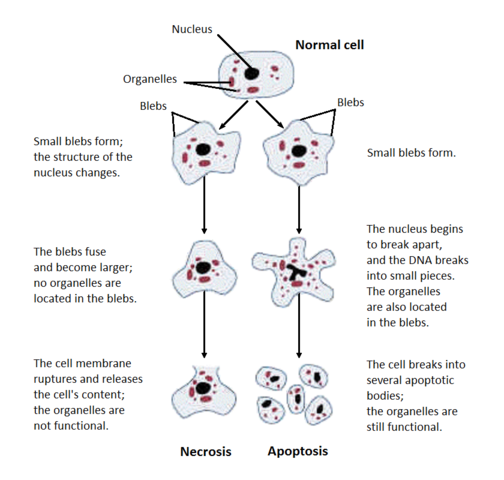
necrose
Necrose is wanneer cellen per ongeluk afsterven door bijvoorbeeld een trauma (bijv. een giftige spinnenbeet), of gebrek aan voedingsstoffen (bijv. gebrek aan bloedtoevoer). Necrose begint met celzwelling, het chromatine wordt verteerd, de plasma- en organelmembranen worden verstoord, het ER vacuoliseert, de organellen breken volledig af en tenslotte lysseert de cel, waarbij de intracellulaire inhoud wordt uitgespuwd en een immuunreactie (ontsteking) wordt opgewekt.
apoptose
Apoptose kan celzelfmoord of celdood betekenen. Cellen plegen zelfmoord wanneer zij geen overlevingssignaal in de vorm van trofische factoren ontvangen, of wanneer zij in hun eigen celkern uitgebreide DNA-schade opmerken. Cellen vermoorden andere cellen om onnodige cellen op te ruimen of om mogelijk zelfaanvallende immuuncellen te elimineren.
Een van beide processen is geprogrammeerde celdood. Tijdens de embryonale ontwikkeling hebben mensen vliezige handen en voeten en staarten; de cellen waaruit die delen bestaan, apoptoseren later. Apoptose vindt ook voortdurend plaats in veel weefsels, waaronder de darmen.
Hier is een prachtige Wikimedia Commons-afbeelding van apoptose (lees van links naar rechts, van boven naar beneden) met dank aan Egelberg:
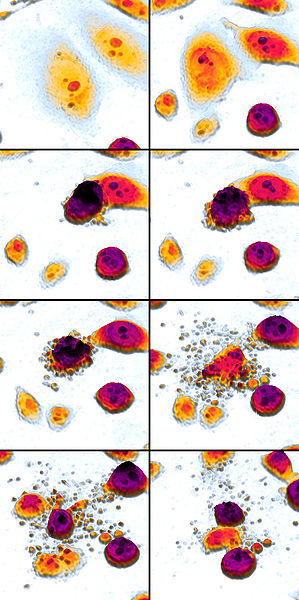
De belangrijkste stappen van apoptose:
- Cel krimpt
- Cel fragmenteert
- Cytoskelet stort in
- Nucleaire envelop demonteert
- Cellen laten apoptotische lichaampjes los
Notably absent in dit lijstje is ‘een signaal afgeven.’ Apoptotische cellen zenden geen signaal uit, met één uitzondering: ze laten apoptotische lichaampjes en ‘engulfment-eiwitten’ los om andere cellen (‘fagocyterende’ cellen) ertoe aan te zetten de apoptotische lichaampjes op te slokken en in hun lysosomen af te breken, maar dit is niet echt een immuunrespons.
Proteïnen die belangrijk zijn bij apoptose:
- ‘killer-eiwitten’: de caspasen (hieronder in detail besproken).
- ‘vernietigingseiwitten’ die DNA verteren, de cel fragmenteren en het cytoskelet afbreken
- ‘opslokkingseiwitten’ die fagocytose door andere cellen uitlokken en bevorderen
C. elegans is het belangrijkste modelorganisme geweest voor het begrijpen van apoptose, zowel door voorwaartse als door omgekeerde genetica. Voorwaartse genetica is het waarnemen van een fenotype en dan bepalen welk gen dit fenotype veroorzaakt; omgekeerde genetica is het introduceren van een mutatie in een bekend gen om te zien welk fenotype het gevolg is.
De belangrijkste route in de apoptose bij C. elegans wordt weergegeven in deze Google-tekening die ik heb gemaakt:
Hier volgt een uitleg van hoe elk van deze eiwitten zijn werk doet, van onder naar boven:
zijn:
- CED-3 haalt de trekker over, waardoor apoptotische eiwitten worden geactiveerd die de cel vernietigen. (In het zoogdierenequivalent is CED-3 Caspase 9, die Caspase 3 splitst en daarmee activeert, die op zijn beurt de cel vernietigt.)
- CED-4 activeert CED-3.
- CED-9 bindt zich aan CED-4 en voorkomt diens activering
- EGL-1 wordt transcriptioneel geactiveerd als reactie op doodssignalen en katalyseert het vrijkomen van CED-4 uit CED-9.
Merk op dat er geen robuustheid in dit systeem zit – het is altijd single points of failure. Als CED-3 wordt uitgeschakeld, kan geen apoptose optreden. Als CED-4 wordt uitgeschakeld, kan er geen apoptose optreden. Als CED-9 wordt uitgeschakeld, zal elke cel in de worm apoptose vertonen. Als EGL-1 wordt uitgeschakeld, kan er geen apoptose optreden. Merk op dat de volgorde waarin de pijlen in het bovenstaande diagram wijzen, de informatiestroom in het systeem weergeeft. Als bijvoorbeeld EGL-1 en CED-9 allebei worden uitgeschakeld, is dat hetzelfde als wanneer alleen CED-9 wordt uitgeschakeld: elke cel zal apoptose vertonen.
In zoogdieren wordt apoptose hoofdzakelijk bepaald door caspasen (cysteïne-aspartische proteasen). De gehele caspasepathway is post-translationeel gereguleerd: de caspasen zijn altijd in inactieve vorm aanwezig (procaspasen genaamd, die een prodomain bevatten, dat een caspase recruitment domain (CARD) bevat) en kunnen door splitsing worden geactiveerd. Dit maakt een zeer snelle reactie mogelijk als celzelfmoord nodig is. Om apoptose te laten plaatsvinden, moeten de initiërende caspasen worden gekliefd en gedimeriseerd. Vervolgens moeten zij de effector-caspasen (ook pro-caspasen genoemd) splitsen, waardoor een “caspase-cascade” op gang wordt gebracht. Hierdoor wordt het aantal geactiveerde caspasen in de cel vergroot. De effector-caspasen hebben vele doelwitten, waaronder de nucleaire lamina en het cytoskelet.
Er zijn zowel pro-overlevings- als pro-apoptotische caspasen, en zij hebben veel gemeenschappelijke domeinen. Pro-overlevingscaspasen hebben BH1, 2, 3 en 4; pro-apoptose-caspasen hebben BH1, 2 en 3 of alleen BH3.
Inhibitor of apoptosis proteins (IAP’s) houden zowel de initiator- als de effector-caspasen in toom. Zij hebben elk een zinkbindend domein dat zich direct aan caspasen bindt, waardoor hun activiteit wordt geremd.
Echter zijn er ook mitochondriale eiwitten, SMAC en DIABLO genaamd, die de remmers remmen. Bij mitochondriaal letsel komen ze vrij en binden ze IAP’s, waardoor de caspasen vrijkomen om apoptose te veroorzaken. Een andere verzameling mitochondriale eiwitten, Htra2/Omi, apoptose-inducerende factor (AIF) en endonuclease G, kan ook vrijkomen en zal de IAP’s splitsen. AIF veroorzaakt ook chromosoomcondensatie en DNA-fragmentatie, onafhankelijk van caspasen.
Inderdaad zijn de mitochondriën centrale regulatoren van apoptose. De buitenste mitochondriale membraaneiwitten Bcl-2, de BH3-only eiwitten en Bax zijn hierbij betrokken: Bax kan een porie vormen in het membraan om cytochroom c, dat zich normaal in de intermembraanruimte bevindt, door te laten naar het cytosol. Bax-monomeren verplaatsen zich van het cytoplasma naar het buitenste mitochondriale membraan, waar zij oligomeriseren en de instroom van ionen door het membraan mogelijk maken. Dit is ook aangetoond in in vitro-experimenten, waarbij kan worden aangetoond dat blaasjes van buitenmitochondriaal membraan in aanwezigheid van Bax worden permeabiliseerd. Het is op dit moment niet bekend waarom deze instroom van ionen leidt tot het vrijkomen van cytochroom c.
Bcl-2 voorkomt het vrijkomen van cytochroom c, waardoor apoptose wordt geblokkeerd. Bcl-2 was het eerste apoptosegen van zoogdieren dat werd gekloond. In sommige lymfomen wordt het getranslokeerd naar een positie onder een sterkere promotor, waardoor overexpressie ontstaat die verhindert dat de kankercel apoptoseert. Zie ook slecht & bod.
Als cytochroom c vrijkomt, bindt het zich aan Apaf-1 (apoptotic protease activating factor), waardoor dit laatste het ATP waaraan het gewoonlijk gebonden is, hydrolyseert, hetgeen een conformatieverandering teweegbrengt die Apaf-1 activeert en de caspase cascade in gang zet. Apaf-1 vormt een schijfvormig heptoom dat het ‘wiel des doods’ of apoptosoom wordt genoemd en dat de caspasen activeert (Wikimedia Commons afbeelding door Org1012):
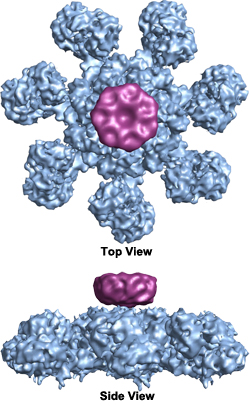
Wanneer een trofische factor aanwezig is, activeert de receptor PI3K, dat PKB/Akt activeert, dat Bad fosforyleert. p-Bad wordt vervolgens door 14-3-3 in het cytosol vastgehouden, waardoor p-Bad niet in staat is Bcl-2 te remmen. Zo wordt apoptose voorkomen.
Trofische factoren zijn een voorbeeld van een extrinsiek signaal dat de overleving van cellen bevordert. Er zijn ook extrinsieke signalen die de dood bevorderen (dit is celdood). Tumor necrose factor (TNF-alfa) wordt door macrofagen afgegeven om de celdood in gang te zetten door binding aan ‘doodsreceptoren’. Doodsreceptoren hebben een enkel transmembraandomein. Zij moeten trimeriseren om FADD (Fas-geassocieerd doodsdomein) te activeren. Deze dienen als adapters voor caspase-8 en -10 en vormen een dood-inducerend signaleringscomplex (DISC) dat de caspasecascade in gang kan zetten. Hoewel dit hele proces onafhankelijk van de mitochondria ontstaat, kan het ook (?) t-Bid activeren, waardoor ook een mitochondriaal apoptose-signaal ontstaat.
Cellen kunnen moordresistent worden door decoy-receptoren tot expressie te brengen die alleen het ‘death ligand’-bindingsdomein hebben en geen actief cytosolisch domein. Dit komt soms normaal voor in dierlijke cellen, maar is ook een truc die sommige virussen gebruiken – zij coderen decoy-receptoreiwitten om hun gastheercellen te vrijwaren van immuunaanvallen.
TNF-alfa bevordert gewoonlijk de dood, maar kan in bepaalde celtypen ook de overleving bevorderen door NF-κB te activeren. Soms gebruiken cellen decoy-receptoren om een ontstekingsreactie te bevorderen in plaats van de dood.
p53 is een belangrijke regulator van de DNA-schaderespons en kan DNA-reparatie, apoptose of celcyclusstilstand bevorderen. Het doet dit door zich te binden aan promotors van doelgenen. Het is nog steeds niet duidelijk wat bepaalt wanneer p53 celcyclusstilstand induceert versus apoptose.
experimentele methoden
Apoptotische cellen vertonen een bepaalde chemische signatuur. Een daarvan is dat een endonuclease het DNA in fragmenten splitst in de linkergebieden tussen nucleosomen en dat de resulterende fragmenten een ladder vormen wanneer ze op een gel worden gelegd. Een andere methode is TUNEL-kleuring (Terminal deoxynucleotide transferase dUTP Nick End Labeling). Hierbij worden een Tdt-enzym en BrdU toegevoegd, die door Tdt aan de uiteinden van het gesplitste DNA worden toegevoegd. Nadat het de kans heeft gekregen dit te doen, wordt het teveel aan BrdU weggespoeld en wordt vervolgens een antilichaam tegen BrdU gebruikt. Nog een andere methode is dat fosfatidylserine (PS) zich normaal in het cytosolische blad van de plasmamembraan bevindt; tijdens apoptose verschuift het naar het exoplasmatische blad, waar het dient als signaal om andere cellen te verzoeken de stervende cel te fagocytoseren. Een fluorescent gelabeld annexine V eiwit kan PS aan de buitenkant van apoptotische cellen labelen.
Dubbelstrengs DNA kan niet door het plasmamembraan van intacte cellen – en dat zijn gezonde cellen en apoptotische cellen. Als het wel naar buiten komt, is dat een teken van necrose. Je kunt dus kleuren met annexine V voor exoplasmatisch PS en met 7-AAD voor dsDNA; apoptotische cellen zijn die welke positief zijn voor annexine V maar negatief voor 7-AAD.
afsluitende video
In het kort, hier is een verontrustende video over apoptose:
relevantie voor PrP
In het algemeen sterven cellen in de natuur ofwel door apoptose, necrose of door autofagie (wat in dit geval betekent dat ze in hun geheel worden opgeslokt door andere cellen). Er zijn niet echt andere manieren om te gaan. Een van de vele mysterieuze dingen over prionziekten is hoe neuronen sterven in de prion-geïnfecteerde hersenen – ze lijken duidelijk geen van deze paden te volgen. Hier volgt een citaat uit een uitstekend recent artikel over toxische mechanismen van prionziekten:
Caspase 12-splitsing trad op bij 10wpi, na stijgende CHOP-expressie… samenvallend met het begin van neuronaal verlies… maar het precieze effectormechanisme van neuronale dood is onduidelijk: we vonden noch apoptose, noch autofagie, noch necrose bij onderzoek van hippocampale plakjes… en noch Bax-deletie, noch Bcl-2-overexpressie, noch caspase 12-deficiëntie zijn neuroprotectief bij prionziekte.
Naast haar eigen bewijs haalt Moreno de studie aan van prioninfectie in muismodellen met Bax (een pro-apoptotisch eiwit) verwijderd of Bcl-2 (een anti-apoptotisch eiwit) overgeëxpresseerd – twee verschillende manieren om apoptose te blokkeren. Geen van deze muismodellen vertoonde enige vertraging of verbetering van de prionziekte. Een ander apoptotisch eiwit, Caspase-12, ondergaat proteolytische verwerking tijdens prion-infectie, maar deletie van Caspase-12 veranderde het verloop van prionziekte ook niet.