Leerresultaten
- Identificeer soorten receptoren, hun moleculaire samenstelling en de verschillen daartussen
Receptoren zijn eiwitmoleculen in de doelcel of op zijn oppervlak die ligand binden. Er zijn twee soorten receptoren: interne receptoren en receptoren op het celoppervlak.
Interne receptoren

Figuur 1. Hydrofobe signaalmoleculen diffunderen gewoonlijk over het plasmamembraan en interageren met intracellulaire receptoren in het cytoplasma. Veel intracellulaire receptoren zijn transcriptiefactoren die een wisselwerking aangaan met het DNA in de celkern en de genexpressie reguleren.
Interne receptoren, ook wel intracellulaire of cytoplasmatische receptoren genoemd, bevinden zich in het cytoplasma van de cel en reageren op hydrofobe ligandmoleculen die in staat zijn zich over het plasmamembraan te verplaatsen. Eenmaal in de cel binden veel van deze moleculen zich aan eiwitten die fungeren als regulatoren van de mRNA-synthese (transcriptie) om de genexpressie te mediëren. Genexpressie is het cellulaire proces waarbij de informatie in het DNA van een cel wordt omgezet in een reeks aminozuren, die uiteindelijk een eiwit vormen. Wanneer het ligand bindt aan de interne receptor, wordt een conformatieverandering teweeggebracht die een DNA-bindende plaats op het eiwit blootlegt. Het ligand-receptorcomplex beweegt zich naar de kern, bindt zich vervolgens aan specifieke regulerende regio’s van het chromosomale DNA en bevordert de initiatie van transcriptie (figuur 1). Transcriptie is het proces waarbij de informatie in het DNA van een cel wordt gekopieerd naar een speciale vorm van RNA die boodschapper-RNA (mRNA) wordt genoemd; de cel gebruikt de informatie in het mRNA (dat zich naar het cytoplasma verplaatst en zich met ribosomen associeert) om specifieke aminozuren in de juiste volgorde aan elkaar te koppelen, waardoor een eiwit wordt geproduceerd. Interne receptoren kunnen de genexpressie direct beïnvloeden zonder het signaal te hoeven doorgeven aan andere receptoren of boodschappers.
Cell-Surface Receptoren
Cell-surface receptoren, ook wel transmembraanreceptoren genoemd, zijn aan het celoppervlak, membraan-verankerde (integrale) eiwitten die zich binden aan externe ligandmoleculen. Dit type receptor omspant het plasmamembraan en voert signaaltransductie uit, waarbij een extracellulair signaal wordt omgezet in een intercellulair signaal. Liganden die in wisselwerking staan met receptoren op het celoppervlak hoeven de cel die zij beïnvloeden niet binnen te gaan. Cel-oppervlakte-receptoren worden ook wel cel-specifieke eiwitten of markers genoemd, omdat ze specifiek zijn voor individuele celtypen.
Elke cel-oppervlakte-receptor heeft drie hoofdcomponenten: een extern ligand-bindend domein, een hydrofoob membraan-spannend gebied, en een intracellulair domein binnenin de cel. Het ligand-bindende domein wordt ook wel het extracellulaire domein genoemd. De grootte en de omvang van elk van deze domeinen varieert sterk, afhankelijk van het type receptor.
Omdat receptoreiwitten op het celoppervlak van fundamenteel belang zijn voor het normaal functioneren van cellen, mag het geen verrassing heten dat een storing in een van deze eiwitten ernstige gevolgen kan hebben. Het is aangetoond dat fouten in de eiwitstructuren van bepaalde receptormoleculen een rol spelen bij hypertensie (hoge bloeddruk), astma, hartziekten en kanker.
Hoe virussen een gastheer herkennen
In tegenstelling tot levende cellen hebben veel virussen geen plasmamembraan of andere structuren die nodig zijn om leven in stand te houden. Sommige virussen bestaan gewoon uit een inert eiwitomhulsel met DNA of RNA. Om zich voort te planten moeten virussen een levende cel binnendringen, die als gastheer dient, en vervolgens het cellulaire apparaat van de gastheer overnemen. Maar hoe herkent een virus zijn gastheer?
Virussen binden zich vaak aan receptoren op het celoppervlak van de gastheercel. Het virus dat de menselijke griep veroorzaakt, bindt zich bijvoorbeeld specifiek aan receptoren op membranen van cellen van het ademhalingsstelsel. Chemische verschillen in de cel-oppervlakte-receptoren tussen gastheren betekenen dat een virus dat een specifieke soort (bijvoorbeeld de mens) infecteert, geen andere soort (bijvoorbeeld kippen) kan infecteren.
Virussen hebben echter zeer kleine hoeveelheden DNA of RNA in vergelijking met mensen, en als gevolg daarvan kan virale reproductie snel plaatsvinden. Bij de voortplanting van virussen worden steevast fouten gemaakt die kunnen leiden tot veranderingen in de nieuw geproduceerde virussen; deze veranderingen houden in dat de virale eiwitten die in wisselwerking staan met receptoren op het celoppervlak zodanig kunnen evolueren dat zij zich kunnen binden aan receptoren in een nieuwe gastheer. Dergelijke veranderingen doen zich willekeurig en vrij vaak voor in de voortplantingscyclus van een virus, maar de veranderingen zijn alleen van belang als een virus met nieuwe bindingseigenschappen in contact komt met een geschikte gastheer. In het geval van influenza kan deze situatie zich voordoen in omgevingen waar dieren en mensen nauw met elkaar in contact staan, zoals pluimvee- en varkenshouderijen. Zodra een virus op een nieuwe gastheer overspringt, kan het zich snel verspreiden. Wetenschappers houden nieuw opduikende virussen (opkomende virussen genoemd) nauwlettend in de gaten in de hoop dat dit de kans op wereldwijde virusepidemieën kan verkleinen.
Receptoren op celoppervlakken zijn betrokken bij de meeste signaleringen in meercellige organismen. Er zijn drie algemene categorieën van cel-oppervlakte receptoren: ionkanaal-gebonden receptoren, G-eiwit-gebonden receptoren, en enzym-gebonden receptoren.

Figuur 2. Gated ionkanalen vormen een porie in het plasmamembraan die opengaat wanneer de signaalmolecule bindt. De geopende porie laat vervolgens ionen de cel in of uit stromen.
Ionkanaal-gebonden receptoren binden een ligand en openen een kanaal door het membraan dat specifieke ionen doorlaat. Om een kanaal te kunnen vormen, heeft dit type receptor op het celoppervlak een uitgebreid membraanoverspannend gebied. Om te kunnen interageren met de fosfolipide vetzuurstaarten die het centrum van het plasmamembraan vormen, zijn veel van de aminozuren in het membraan-overspannende gebied hydrofoob van aard. Omgekeerd zijn de aminozuren aan de binnenzijde van het kanaal hydrofiel om de doorgang van water of ionen mogelijk te maken. Wanneer een ligand zich bindt aan de extracellulaire regio van het kanaal, vindt er een conformatieverandering plaats in de structuur van het eiwit waardoor ionen zoals natrium, calcium, magnesium en waterstof kunnen passeren (Figuur 2).
G-eiwit-gebonden receptoren binden een ligand en activeren een membraaneiwit dat een G-eiwit wordt genoemd. Het geactiveerde G-eiwit gaat vervolgens een interactie aan met ofwel een ionkanaal ofwel een enzym in het membraan (figuur 3). Alle G-eiwitgebonden receptoren hebben zeven transmembraandomeinen, maar elke receptor heeft zijn eigen specifieke extracellulaire domein en G-eiwitbindingsplaats.
Celsignalering met behulp van G-eiwitgebonden receptoren verloopt als een cyclische reeks gebeurtenissen. Voordat het ligand bindt, kan het inactieve G-eiwit zich binden aan een nieuw onthulde plaats op de receptor die specifiek is voor zijn binding. Zodra het G-eiwit aan de receptor bindt, activeert de resulterende vormverandering het G-eiwit, dat GDP vrijgeeft en GTP oppikt. De subeenheden van het G-eiwit splitsen zich vervolgens in de α-subeenheid en de βγ-subeenheid. Een of beide van deze G-eiwitfragmenten kunnen als gevolg daarvan andere eiwitten activeren. Na enige tijd wordt het GTP op de actieve α-subeenheid van het G-eiwit gehydrolyseerd tot GDP en wordt de βγ-subeenheid gedeactiveerd. De subeenheden associëren weer tot het inactieve G-eiwit en de cyclus begint opnieuw.
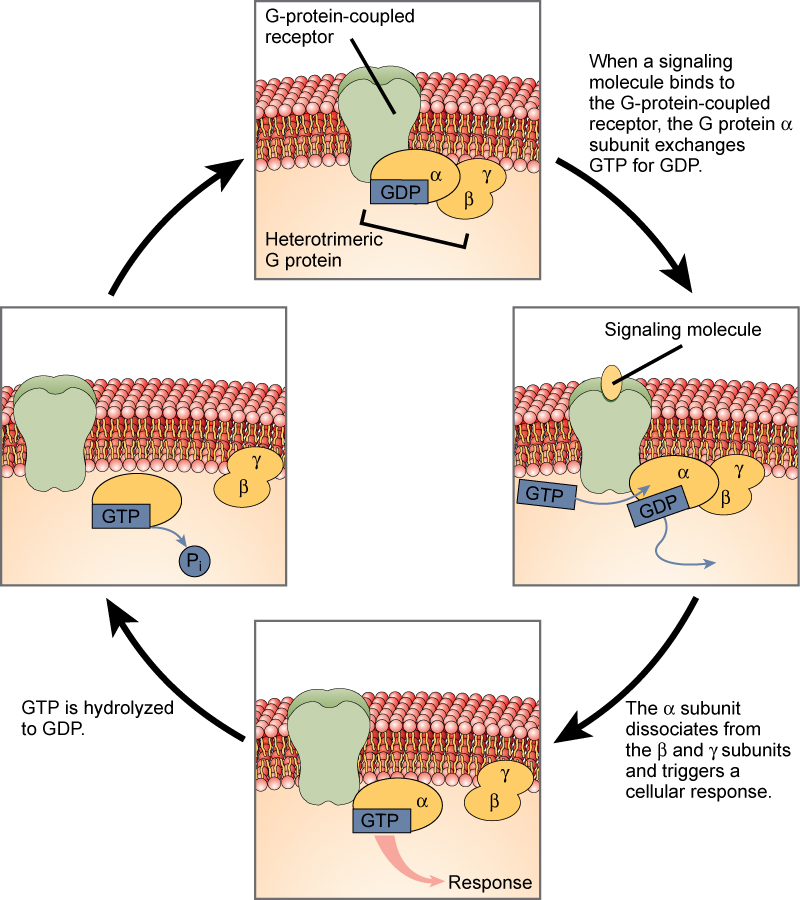
Figuur 3. Heterotrimere G-eiwitten hebben drie subeenheden: α, β en γ. Wanneer een signaalmolecuul bindt aan een G-eiwitgekoppelde receptor in het plasmamembraan, wordt een met de α-subeenheid geassocieerd GDP-molecuul uitgewisseld voor GTP. De β- en γ-subeenheden dissociëren van de α-subeenheid, en een cellulaire respons wordt ofwel door de α-subeenheid of door het gedissocieerde βγ-paar in gang gezet. Hydrolyse van GTP naar GDP beëindigt het signaal.
G-eiwit-gekoppelde receptoren zijn uitgebreid bestudeerd en er is veel geleerd over hun rol bij het handhaven van de gezondheid. Bacteriën die pathogeen zijn voor de mens kunnen giffen afgeven die specifieke G-eiwitgebonden receptorfuncties onderbreken, wat leidt tot ziekten als pertussis, botulisme en cholera.

Figuur 4. Cholera wordt voornamelijk overgebracht via besmet drinkwater en is een belangrijke doodsoorzaak in ontwikkelingslanden en in gebieden waar de beschikbaarheid van schoon water door natuurrampen wordt onderbroken. (credit: New York City Sanitary Commission)
Bij cholera (figuur 4), bijvoorbeeld, produceert de in water voorkomende bacterie Vibrio cholerae een toxine, cholerageen, dat zich bindt aan cellen die de dunne darm bekleden. Het toxine dringt vervolgens deze darmcellen binnen, waar het een G-eiwit wijzigt dat de opening van een chloridekanaal regelt en ervoor zorgt dat dit kanaal continu actief blijft, met als gevolg een groot verlies van lichaamsvocht en mogelijk fatale uitdroging.
Moderne sanitaire voorzieningen elimineren de dreiging van cholera-uitbraken, zoals die welke in 1866 New York City overspoelde. Deze poster uit die tijd laat zien dat men toen nog niet begreep hoe de ziekte werd overgebracht.
Enzyme-linked receptors zijn receptoren op het celoppervlak met intracellulaire domeinen die zijn geassocieerd met een enzym. In sommige gevallen is het intracellulaire domein van de receptor zelf een enzym. Andere enzymgekoppelde receptoren hebben een klein intracellulair domein dat rechtstreeks met een enzym interageert. De enzymgekoppelde receptoren hebben normaliter grote extracellulaire en intracellulaire domeinen, maar het membraanoverspannende gebied bestaat uit een enkele alfa-helicale regio van de peptidestreng. Wanneer een ligand aan het extracellulaire domein bindt, wordt een signaal door het membraan gestuurd, waardoor het enzym wordt geactiveerd. De activering van het enzym brengt een keten van gebeurtenissen in de cel op gang die uiteindelijk tot een reactie leidt. Een voorbeeld van dit type enzym-gekoppelde receptor is de tyrosinekinase-receptor (figuur 5). Een kinase is een enzym dat fosfaatgroepen van ATP overbrengt naar een ander eiwit. De tyrosinekinase-receptor brengt fosfaatgroepen over op tyrosinemoleculen (tyrosineresiduen). Eerst binden signaalmoleculen zich aan het extracellulaire domein van twee naburige tyrosinekinase-receptoren. De twee naburige receptoren binden zich vervolgens aan elkaar, of dimeren. Vervolgens worden fosfaten toegevoegd aan tyrosineresiduen op het intracellulaire domein van de receptoren (fosforylering). De gefosforyleerde residuen kunnen dan het signaal doorgeven aan de volgende boodschapper in het cytoplasma.
Praktijkvraag

Figuur 5. Een receptor tyrosinekinase is een enzymgebonden receptor met een enkel transmembraangebied en extracellulaire en intracellulaire domeinen. Binding van een signaalmolecuul aan het extracellulaire domein zorgt ervoor dat de receptor gaat dimeren. Tyrosineresiduen op het intracellulaire domein worden vervolgens zelfgefosforyleerd, waardoor een downstream cellulaire respons wordt uitgelokt. Het signaal wordt beëindigd door een fosfatase die de fosfaten van de fosfotyrosineresiduen verwijdert.
HER2 is een receptor tyrosinekinase. In 30 procent van de borstkankers bij de mens is HER2 permanent geactiveerd, wat leidt tot ongereguleerde celdeling. Lapatinib, een geneesmiddel dat wordt gebruikt om borstkanker te behandelen, remt de autofosforylering van HER2-receptor tyrosinekinase (het proces waarbij de receptor fosfaten aan zichzelf toevoegt), waardoor de tumorgroei met 50 procent wordt verminderd. Welke van de volgende stappen, naast autofosforylering, zou door Lapatinib worden geremd?
- Binding van signaalmoleculen, dimerisatie, en de downstream cellulaire respons
- Dimerisatie, en de downstream cellulaire respons
- De downstream cellulaire respons
- Fosfatase activiteit, dimerisatie, en de downstream cellulaire respons
Probeer het
Bijdragen!
Verbeter deze paginaLees meer