In simplistische termen voeren antilichamen twee hoofdfuncties uit in verschillende gebieden van hun structuur. Terwijl één deel van het antilichaam, het antigeenbindende fragment (Fab), het antigeen herkent, staat het andere deel van het antilichaam, bekend als het kristalliseerbare fragment (Fc), in wisselwerking met andere elementen van het immuunsysteem, zoals fagocyten of componenten van de complementroute, om de verwijdering van het antigeen te bevorderen.
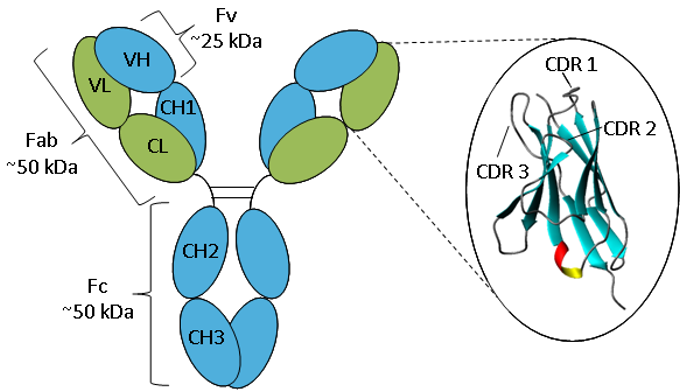
Figuur. Schematische weergave van een IgG.
Een antilichaam bestaat uit twee zware ketens (blauw) en twee lichte ketens (groen) die tot constante en variabele domeinen zijn gevouwen. De vergroting van het variabele domein toont een lintvormige voorstelling van het β-sheet raamwerk en de CDR-lussen.
Antilichamen hebben allemaal dezelfde basisstructuur, bestaande uit twee zware en twee lichte ketens die twee Fab-armen vormen met identieke domeinen aan beide uiteinden, die door een flexibel scharniergebied zijn bevestigd aan de stam van het antilichaam, het Fc-domein, waardoor de klassieke ‘Y’-vorm ontstaat. De ketens vouwen zich in herhaalde immunoglobuline plooien bestaande uit antiparallelle β-sheets (1), die hetzij constante, hetzij variabele domeinen vormen. De Fab-domeinen bestaan uit twee variabele en twee constante domeinen, waarbij de twee variabele domeinen het variabele fragment (Fv) vormen, dat zorgt voor de antigeenspecificiteit van het antilichaam (2), terwijl de constante domeinen fungeren als een structureel kader. Elk variabel domein bevat drie hypervariabele lussen, die complementariteitsbepalende regio’s (CDR’s) worden genoemd en gelijkmatig verdeeld zijn over vier minder variabele kaderregio’s (FR). Het zijn de CDR’s die zorgen voor een specifieke antigeen-herkenningsplaats op het oppervlak van het antilichaam en de hypervariabiliteit van deze gebieden stelt antilichamen in staat een bijna onbeperkt aantal antigenen te herkennen (3).
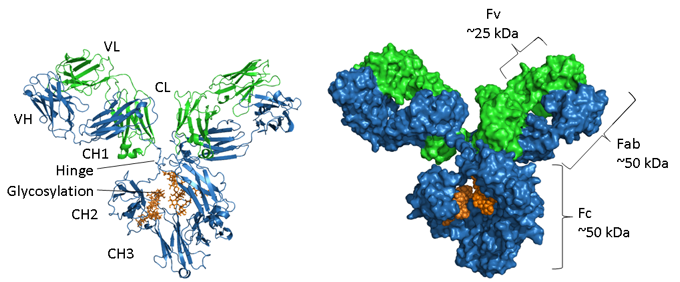
Figuurtje. Structuurvoorstellingen van een IgG.
De zware keten is weergegeven in blauw, de lichte keten in groen en de glycosylering in oranje. Links is een lintweergave met de secundaire structuurelementen en rechts is een ruimtevullend model van hetzelfde molecuul. Het PDB-toetredingsnummer van de muis IgG1 is 1IGY.
Antilichamen zijn geglycosyleerde eiwitten, waarbij de positie en de mate van glycosylering per isotype verschilt. Zoals te zien is in de afbeelding hierboven, bestaat de Fc-regio van een IgG uit twee gepaarde CH3-domeinen en, daarentegen, twee CH2-domeinen die van elkaar gescheiden zijn en niet op elkaar inwerken, maar waartussen twee oligosaccharideketens zijn geplaatst. Deze ketens bedekken de hydrofobe vlakken die normaliter tot domeinparen zouden leiden. De N-glycanen bevatten een gemeenschappelijk kerngebied van twee N-acetyl-glucosamineresten (GlcNAc) verbonden met een asparagine (N297 in menselijk IgG1) via een amidebinding en drie mannoseresiduen. Deze kernstructuur kan extra eindsuikers bevatten, zoals mannose, GlcNac, galactose, fucose en siaalzuur, waardoor een grote heterogeniteit ontstaat (4).
<< Een korte geschiedenis van antilichamen Antilichaam-isotypen & subtypen >>
<< Antilichamenoverzicht >>
- Poljak, R.J., Amzel, L.M., Avey, H.P., Chen, B.L., Phizackerley, R.P., and Saul, F. (1973). Driedimensionale structuur van het Fab’-fragment van een humaan immunoglobuline met een resolutie van 2,8 A. Proc. Natl. Acad. Sci. U.S.A. 70, 3305-3310.
- Inbar, D., Hochman, J., and Givol, D. (1972). Localization of antibody-combining sites within the variable portions of heavy and light chains. Proc. Natl. Acad. Sci. U.S.A. 69, 2659-2662.
- Morea, V., Lesk, A.M., and Tramontano, A. (2000). Antibody modeling: implications for engineering and design. Methods 20, 267-279.
- Wright, A., and Morrison, S.L. (1998). Effect of C2-associated carbohydrate structure on Ig effector function: studies with chimeric mouse-human IgG1 antibodies in glycosylation mutants of Chinese hamster ovary cells. J. Immunol. 160, 3393-3402.