Geleidbaarheid
Een andere kenmerkende eigenschap van ionische verbindingen is hun elektrische geleidbaarheid. Onderstaande figuur toont drie experimenten waarbij twee elektroden die verbonden zijn met een gloeilamp in bekers met drie verschillende stoffen worden geplaatst.
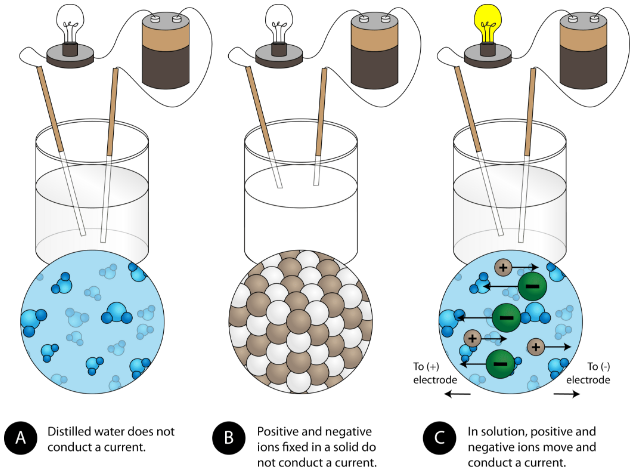
In het eerste bekerglas geleidt gedestilleerd water geen stroom omdat water een moleculaire verbinding is. In het tweede bekerglas geleidt vast natriumchloride ook geen stroom. Hoewel het ionisch is en dus uit geladen deeltjes bestaat, zorgt het vaste kristalrooster ervoor dat de ionen zich niet tussen de elektroden kunnen verplaatsen. Mobiele geladen deeltjes zijn nodig om de stroomkring te voltooien en de lamp te laten branden. In het derde bekerglas is het NaCl opgelost in het gedestilleerd water. Nu is het kristalrooster uiteengevallen en kunnen de afzonderlijke positieve en negatieve ionen zich verplaatsen. Kationen bewegen naar de ene elektrode, terwijl anionen naar de andere elektrode bewegen, waardoor elektriciteit kan stromen (zie onderstaande figuur). Het smelten van een ionische verbinding maakt de ionen ook vrij om een stroom te geleiden. Ionische verbindingen geleiden een elektrische stroom wanneer ze gesmolten of opgelost zijn in water. Het oplossen van ionische verbindingen in water wordt besproken in paragraaf 9.3.
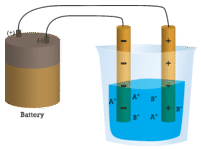
Voorbeeld
(\PageIndex{1})
Schrijf de dissociatievergelijking van vast NaCl in water.
Oplossing
NaCl(s) → Na+(aq) + Cl-(aq)
Oefening >(\PageIndex{1})
Schrijf de dissociatievergelijking van vast NH4NO3 in water.
Antwoord
NH4NO3(s) → NH4+(aq) + NO3-(aq)