簡単に言うと、抗体はその構造の異なる領域で2つの主な機能を果たしています。 抗体の一部分である抗原結合断片(Fab)が抗原を認識する一方で、結晶化可能な断片(Fc)として知られる抗体の他の部分は、食細胞や補体経路の構成要素などの免疫系の他の要素と相互作用して、抗原の除去を促進します。
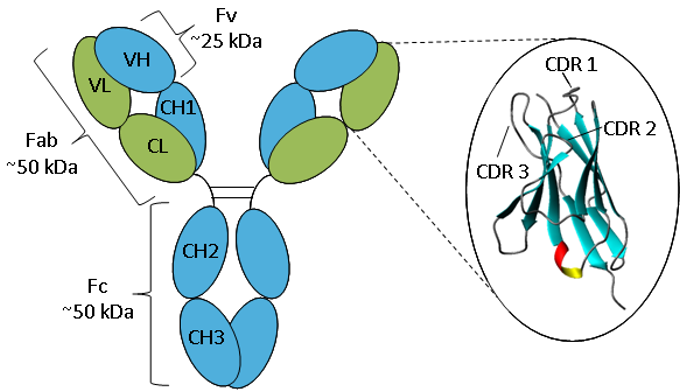
図. IgGの模式図。
抗体は、2本の重鎖(青)と2本の軽鎖(緑)が折り重なって、定数ドメインと可変ドメインになっている。
抗体はすべて、2本の重鎖と2本の軽鎖からなる基本構造が同じで、両端に同一のドメインを持つ2本のFabアームを形成し、柔軟なヒンジ領域によって抗体の幹であるFcドメインに取り付けられており、古典的な「Y」字形をしています。 鎖は、反平行のβシート(1)からなる免疫グロブリンの繰り返し構造に折り畳まれ、一定または可変のドメインを形成する。 Fabドメインは、2つの可変ドメインと2つの定数ドメインから構成されており、2つの可変ドメインは、抗体の抗原特異性をもたらす可変フラグメント(Fv)を構成し(2)、定数ドメインは構造的枠組みとして機能する。 各可変ドメインには、相補性決定領域(CDR)と呼ばれる3つの超可変ループがあり、4つの少ない可変フレームワーク(FR)領域の間に均等に配置されている。 CDRは、抗体の表面上に特定の抗原認識部位を提供し、これらの領域の多変量性により、抗体はほぼ無限の数の抗原を認識することができます(3)。
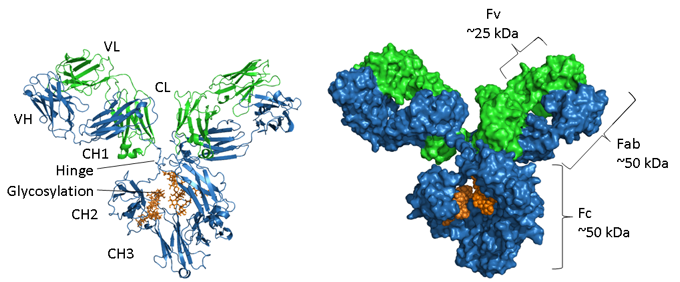
図.
重鎖は青、軽鎖は緑、グリコシル化はオレンジで表示されています。 左側には二次構造の要素を示すリボン表示、右側には同じ分子の空間充填モデルを示している。 マウスIgG1のPDBアクセッション番号は1IGYです。
抗体はグリコシル化されたタンパク質であり、グリコシル化の位置や程度はアイソタイプによって異なります。 上の図のように、IgGのFc領域は、対になった2つのCH3ドメインと、それとは対照的に、離れていて相互作用しない2つのCH2ドメインから構成されているが、それらの間には2つのオリゴ糖鎖が介在している。 これらの鎖は、通常であればドメインがペアになる疎水性の面を覆っている。 N-グリカンは、アスパラギン(ヒトIgG1ではN297)にアミド結合で結合した2つのN-アセチルグルコサミン残基(GlcNAc)と3つのマンノース残基からなる共通のコア領域を含んでいる。 このコア構造には、マンノース、GlcNac、ガラクトース、フコース、シアル酸などの末端糖が付加されている可能性があり、大量の異質性を生み出している(4)。
<<&>>
<<p 抗体の概要 >>
- Poljak, R.J., Amzel, L.M., Avey, H.P., Chen, B.L., Phizackerley, R.P., and Saul, F. (1973). ヒト免疫グロブリンのFab’フラグメントの2,8Å分解能の三次元構造。 Proc. Natl. Acad. Sci. U.S.A. 70, 3305-3310.
- Inbar, D., Hochman, J., and Givol, D. (1972).
- Inbar, D., Hochman, J., and Givol, D. (1972).重鎖および軽鎖の可変部内における抗体結合部位の位置。 Proc. Natl. Acad. Sci. U.S.A. 69, 2659-2662.
- Morea, V., Lesk, A.M., and Tramontano, A. (2000). Antibody modeling: implications for engineering and design. Methods 20, 267-279.
- Wright, A., and Morrison, S.L. (1998). Effect of C2-associated carbohydrate structure on Ig effector function: studies with chimeric mouse-human IgG1 antibodies in glycosylation mutants of Chinese hamster ovary cells. J. Immunol. 160, 3393-3402.
。