学習成果
- 受容体の種類、分子構成、それらの違いを識別する
受容体は、標的細胞内またはその表面にある、リガンドと結合するタンパク質分子です。
内部受容体

細胞内受容体は、細胞内または細胞質内受容体とも呼ばれ、細胞膜を越えて移動できる疎水性リガンド分子に反応します。 細胞内に入ると、これらの分子の多くは、mRNAの合成(転写)を調節するタンパク質と結合し、遺伝子発現を媒介する。 遺伝子発現とは、細胞のDNAの情報をアミノ酸の配列に変換し、最終的にタンパク質を形成する細胞プロセスである。 リガンドが体内の受容体に結合すると、タンパク質のDNA結合部位を露出させる構造変化が引き起こされる。 リガンドと受容体の複合体は核内に移動し、染色体DNAの特定の制御領域に結合して、転写の開始を促す(図1)。 転写とは、細胞のDNAに含まれる情報を、メッセンジャーRNA(mRNA)という特殊な形のRNAにコピーするプロセスである。細胞は、mRNA(細胞質に移動してリボソームと結合する)の情報を利用して、特定のアミノ酸を正しい順序で連結し、タンパク質を生成する。
細胞表面の受容体
細胞表面の受容体は、膜貫通型受容体とも呼ばれ、外部のリガンド分子と結合する細胞表面の膜に固定された(インテグラル)タンパク質である。 このタイプの受容体は、細胞膜を貫通しており、細胞外のシグナルを細胞内のシグナルに変換するシグナル伝達を行う。 細胞表面の受容体と相互作用するリガンドは、影響を与える細胞内に入る必要はない。
細胞表面の受容体は、外部のリガンド結合ドメイン、疎水性の膜貫通領域、細胞内の細胞内ドメインの3つの主要な構成要素を持っています。 リガンド結合ドメインは細胞外ドメインとも呼ばれる。
細胞表面の受容体タンパク質は、細胞が正常に機能するための基本的な要素であるため、これらのタンパク質のどれか1つでも異常があれば、深刻な結果を招くことは驚くことではありません。
ウイルスが宿主を認識する仕組み
多くのウイルスは、生きた細胞とは異なり、細胞膜などの生命維持に必要な構造を持っていません。 ウイルスの中には、DNAやRNAを含む不活性なタンパク質の殻だけで構成されているものもある。 ウィルスが繁殖するためには、宿主となる生きた細胞に侵入し、宿主の細胞装置を乗っ取る必要がある。 しかし、ウイルスはどのようにして宿主を認識するのだろうか。
ウイルスは宿主の細胞表面にある受容体に結合することが多い。 例えば、インフルエンザの原因となるウイルスは、呼吸器系の細胞の膜にある受容体に特異的に結合します。
しかしながら、ウイルスは人間に比べてDNAやRNAの量が非常に少なく、その結果、ウイルスの繁殖が急速に進む。 その結果、細胞表面の受容体と相互作用するウイルスのタンパク質が、新たな宿主の受容体と結合できるように進化することがある。 このような変化は、ウイルスの繁殖サイクルの中でランダムかつ頻繁に起こるが、新しい結合特性を持つウイルスが適切な宿主と接触した場合にのみ、その変化が問題となる。 インフルエンザの場合、このような状況は、養鶏場や養豚場など、動物と人間が密接に接触している環境で起こりうる。 一旦、ウイルスが新しい宿主に飛びつくと、急速に広まります。
細胞表面の受容体は、多細胞生物のシグナル伝達の大部分に関与しています。

図2. ゲート型イオンチャネルは、細胞膜を貫通する孔を形成し、シグナル分子が結合するとその孔が開きます。
イオンチャネルに結合した受容体は、リガンドと結合して、特定のイオンが通過できるチャネルを膜に開きます。 チャネルを形成するために、このタイプの細胞表面の受容体は、広範な膜スパンニング領域を持っています。 細胞膜の中心部を形成するリン脂質の脂肪酸尾部と相互作用するために、膜貫通領域のアミノ酸の多くは疎水性を持つようになっている。 逆に、チャネルの内側に並ぶアミノ酸は、水やイオンの通過を可能にするために親水性になっている。
Gタンパク質に結合した受容体は、リガンドと結合すると、Gタンパク質と呼ばれる膜タンパク質を活性化する。 活性化されたGタンパク質は、膜の中のイオンチャネルや酵素と相互作用する(図3)。
Gタンパク質に結合した受容体を用いた細胞内シグナル伝達は、一連のサイクルで行われる。
リガンドが結合する前に、不活性なGタンパク質は、新たに明らかになった受容体上の結合特異的な部位に結合することができます。 Gタンパク質が受容体に結合すると、その形状変化によってGタンパク質が活性化され、GDPを放出してGTPを拾い上げる。 そして、Gタンパク質のサブユニットは、αサブユニットとβγサブユニットに分かれます。 これらのGタンパク質断片の一方または両方が、結果的に他のタンパク質を活性化することができる。 しばらくすると、活性化したGタンパク質のαサブユニット上のGTPがGDPに加水分解され、βγサブユニットが非活性化される。
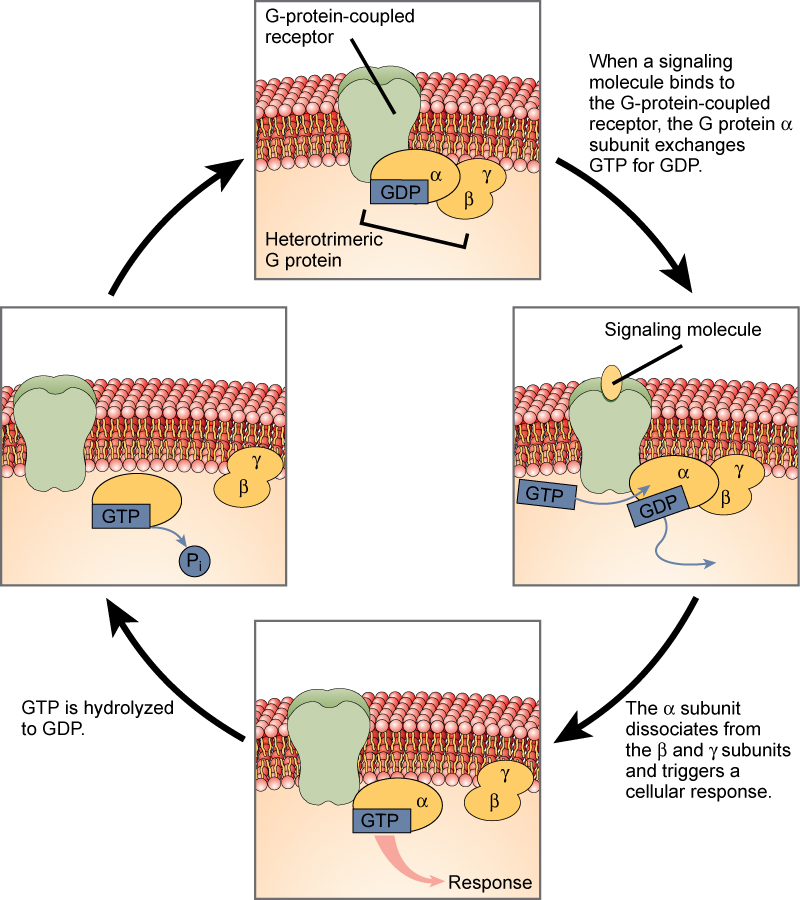
図3. ヘテロ三量体Gタンパク質には、α、β、γの3つのサブユニットがあり、シグナル分子が細胞膜のGタンパク質共役型受容体に結合すると、αサブユニットに結合していたGDP分子がGTPに交換される。 βサブユニットとγサブユニットはαサブユニットから解離し、αサブユニットまたは解離したβγペアによって細胞応答が引き起こされる。
Gタンパク質に結合した受容体は広く研究されており、健康維持における役割について多くのことがわかっています。

図4。 主に汚染された飲料水を介して感染するコレラは、開発途上国や自然災害によって清潔な水が確保できない地域での主要な死因となっています。
例えば、コレラ(図4)では、水を媒介する細菌Vibrio choleraeが、小腸を覆う細胞に結合する毒素choleragenを産生します。
現代の衛生環境では、1866年にニューヨーク市を襲ったようなコレラの大発生の脅威はありません。
酵素結合受容体とは、細胞内にドメインを持つ細胞表面の受容体で、酵素と結合しているものです。 場合によっては、受容体の細胞内ドメイン自体が酵素であることもある。 他の酵素結合型受容体は、酵素と直接相互作用する小さな細胞内ドメインを持っている。 酵素結合型受容体は通常、大きな細胞外ドメインと細胞内ドメインを持つが、膜貫通領域はペプチド鎖の単一のα-へリックス領域からなる。 リガンドが細胞外ドメインに結合すると、シグナルが膜を通して伝達され、酵素が活性化される。 酵素が活性化されると、細胞内で一連のイベントが起こり、最終的には反応が起こることになる。 このタイプの酵素結合型受容体の例として、チロシンキナーゼ受容体が挙げられる(図5)。 キナーゼとは、ATPのリン酸基を別のタンパク質に転移させる酵素のことである。 チロシンキナーゼ受容体は、リン酸基をチロシン分子(チロシン残基)に転移させる。 まず、シグナル分子が、近くにある2つのチロシンキナーゼ受容体の細胞外ドメインに結合する。 その後、隣接する2つの受容体は互いに結合し、すなわち二量体化する。 次に、受容体の細胞内ドメインにあるチロシン残基にリン酸が付加される(リン酸化)。
練習問題

。 受容体チロシンキナーゼは、単一の膜貫通領域、細胞外および細胞内ドメインを持つ酵素結合型の受容体である。 細胞外ドメインにシグナル分子が結合すると、受容体は二量体化する。 その後、細胞内ドメインのチロシン残基が自己リン酸化され、下流の細胞応答が引き起こされる。
HER2は受容体チロシンキナーゼである。
HER2は受容体チロシンキナーゼです。ヒトの乳がんの30%では、HER2が恒常的に活性化され、その結果、無秩序な細胞分裂が起こります。 乳がんの治療薬であるラパチニブは、HER2の受容体チロシンキナーゼの自己リン酸化(受容体が自分自身にリン酸を付加するプロセス)を阻害することで、腫瘍の成長を50%抑えることができます。 自己リン酸化の他に、ラパチニブが阻害するのは次のどのステップでしょうか?
- シグナル分子の結合、二量化、そして下流の細胞応答
- 二量化。 と下流の細胞反応
- ホスファターゼ活性、二量化、下流の細胞反応
Try It
Contribute!
Improve this pageLearn More