厳密に定義すると、イオン化とは原子や分子の種から電子が完全に失われることであり、その結果生じる種はイオンと呼ばれます。
化学式では、イオンの電荷を上付き文字で表します。
イオンはさらにイオン化することがあります。
プラスに帯電したイオンは、しばしば陽イオンと呼ばれます。
イオン化は厳密には正イオンの生成を意味しますが、通常の使い方では負イオンの生成も含みます。
元素の直接イオン化
金属は一般的に陽イオンを形成し、非金属は一般的に陰イオンを形成しますが、炭素、金、希ガスなど、イオンを形成しにくい元素もあります。
周期表1族のアルカリ金属と17族のハロゲン化物は非常に容易にイオン化します。アルカリ金属は電子を1個失うだけで完全な電子殻になり、ハロゲン化物も電子を1個得るだけで完全な電子殻になります。
カリウムと水はイオン化して反応し、イオン化合物である水酸化カリウムと水素が生成されます。
溶液中の分子のイオン化
塩化水素の気体分子は水中で容易にイオン化し、塩酸を生成します。
自己イオン化
水中では、水分子と水の自己イオン化によって生じるイオンとの間に平衡が存在します。 (amphiproticの項参照)
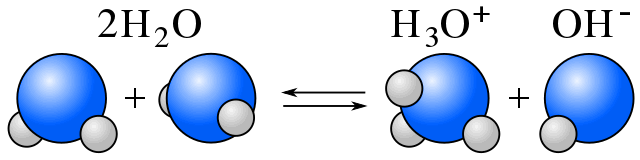
プラズマ中のイオン化
非常に高い温度では、原子から電子が剥がれ落ちてプラズマを形成します。例えば、太陽のコロナでは
ある種の物質から電子を1つ取り除くのに必要なエネルギーがイオン化エネルギーで、2つ目の電子を取り除くのに必要なエネルギーが第2イオン化エネルギー、3つ目の電子を取り除くのに必要なエネルギーが第3イオン化エネルギーといった具合です。
イオン化エネルギーの例
周期表の3列目にある元素の第一イオン化エネルギーは以下の通りです。
第一イオン化エネルギー
| 元素 | 第一イオン化エネルギー(eV) |
|---|---|
| ナトリウム | 5.14 |
| マグネシウム | 7.65 |
| アルミニウム | 5.99 |
| シリコン | 8.15 |
| リン | 10.49 |
| イオウ | 10.36 |
| クロル | 12.97 |
| アルゴン | 15.76 |
明らかに、周期表では左から右に向かってイオン化エネルギーが大きくなる傾向があります。
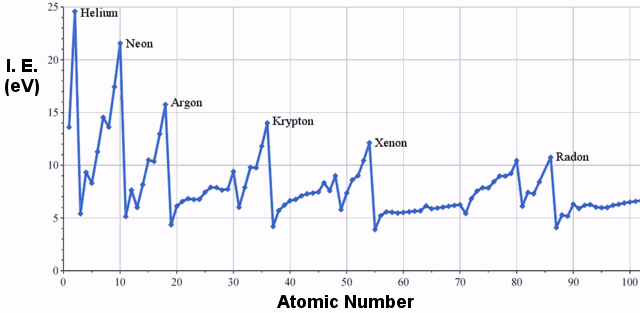

。