
J. J. Thomson führte die Wissenschaft mit seiner Entdeckung des Elektrons im Jahr 1897 – dem ersten subatomaren Teilchen – zu neuen Höhenflügen.
Er fand auch den ersten Beweis, dass stabile Elemente als Isotope existieren können, und erfand eines der leistungsfähigsten Werkzeuge der analytischen Chemie – das Massenspektrometer.
Anfänge: Schule und Universität
Joseph John Thomson wurde am 18. Dezember 1856 in Manchester, England, geboren.
Sein Vater, Joseph James Thomson, führte eine Fachbuchhandlung, die seit drei Generationen in Familienbesitz war. Seine Mutter, Emma Swindells, stammte aus einer Familie, die eine Baumwollfirma besaß.
Bereits als kleiner Junge interessierte sich Joey, der später als J. J. bekannt werden sollte, sehr für die Wissenschaft. Mit 14 Jahren wurde er Student am Owens College, der Universität von Manchester, wo er Mathematik, Physik und Ingenieurwesen studierte.
Da er ein schüchterner Junge war, hofften seine Eltern, dass er eine Lehre als Ingenieur bei einer Lokomotivfirma machen würde. Diese Hoffnungen wurden durch den Tod des Vaters zunichte gemacht, als J. J. 16 Jahre alt war. Die Gebühren für eine Ingenieurslehre waren hoch, und seine Mutter konnte sie nicht aufbringen.
Dieses Unglück kam letztlich der Wissenschaft zugute, denn J. J. musste Mittel finden, um seine Ausbildung fortzusetzen. Im Jahr 1876, im Alter von 19 Jahren, gewann er diese Finanzierung, nicht in den Ingenieurwissenschaften, sondern in der Mathematik an der Universität von Cambridge. Vier Jahre später machte er seinen Abschluss mit Auszeichnung.
Thomson setzte sein Studium in Cambridge fort und gewann 1882 den Adam’s Prize, eine der begehrtesten Mathematik-Auszeichnungen der Universität. Im Jahr 1883 erwarb er einen Master-Abschluss in Mathematik.
Frühe Forschungsarbeiten
Atome
Als Thomson mit seiner Forschungstätigkeit begann, hatte niemand eine klare Vorstellung davon, wie Atome aussehen könnten. Thomson beschloss, sie als einen Rauchring zu visualisieren und zu sehen, wohin die Mathematik, die ein solches Bild beschrieb, ihn führte. Diese Arbeit, für die er sowohl den Adamspreis als auch seinen Masterabschluss erhielt, trug den Titel A Treatise on the Motion of Vortex Rings. Obwohl der Titel und die Anfangskapitel vermuten lassen, dass angewandte Mathematik das Hauptthema war, sind die Überschriften der letzten Abschnitte aufschlussreich:
- Druck eines Gases. Boyle’s Law
- Thermischer Erguss
- Skizze einer chemischen Theorie
- Theorie der Quantenvalenz
- Valenz der verschiedenen Elemente
Thomson drängte seinen mächtigen mathematischen Verstand zu einem tieferen Verständnis der Materie.
Elektrizität und Magnetismus
Zusätzlich zu den Atomen begann Thomson, sich ernsthaft für die Gleichungen von James Clerk Maxwell zu interessieren, die enthüllt hatten, dass Elektrizität und Magnetismus Manifestationen einer einzigen Kraft waren – der elektromagnetischen Kraft – und dass Licht eine elektromagnetische Welle war.
Im Jahr 1893, im Alter von 36 Jahren, veröffentlichte Thomson Notes on Recent Researches in Electricity and Magnetism (Anmerkungen zu den jüngsten Forschungen auf dem Gebiet der Elektrizität und des Magnetismus), die auf Maxwells Arbeit aufbauten. Sein Buch wird manchmal als „Maxwells Gleichungen Band 3“ bezeichnet.
 „Ich wage es, eine alternative Methode zur Betrachtung der Vorgänge im elektrischen Feld zu geben, die ich oft als nützlich empfunden habe und die vom mathematischen Standpunkt aus gleichwertig mit der Maxwellschen Theorie ist.“
„Ich wage es, eine alternative Methode zur Betrachtung der Vorgänge im elektrischen Feld zu geben, die ich oft als nützlich empfunden habe und die vom mathematischen Standpunkt aus gleichwertig mit der Maxwellschen Theorie ist.“
Thomsons bedeutendste Beiträge zur Wissenschaft
Entdeckung des Elektrons – Das erste subatomare Teilchen
Im Jahr 1834 prägte Michael Faraday das Wort Ion, um geladene Teilchen zu beschreiben, die von positiv oder negativ geladenen Elektroden angezogen wurden. Zu Thomsons Zeiten war also bereits bekannt, dass Atome in irgendeiner Weise mit elektrischen Ladungen verbunden sind und dass Atome in ionischen Formen existieren können, die positive oder negative Ladungen tragen. Zum Beispiel besteht Kochsalz aus ionisierten Natrium- und Chloratomen.
Na+: Ein Natrium-Ion mit einer einzelnen positiven Ladung
Cl-: Ein Chlorid-Ion mit einer einzelnen negativen Ladung
Im Jahr 1891 prägte George Johnstone Stoney das Wort Elektron, um die fundamentale Einheit der elektrischen Ladung darzustellen. Er schlug jedoch nicht vor, dass das Elektron als eigenständiges Teilchen existiert. Er glaubte, dass es die kleinste Ladungseinheit darstellte, die ein ionisiertes Atom haben konnte.
Atome wurden immer noch als unteilbar angesehen.
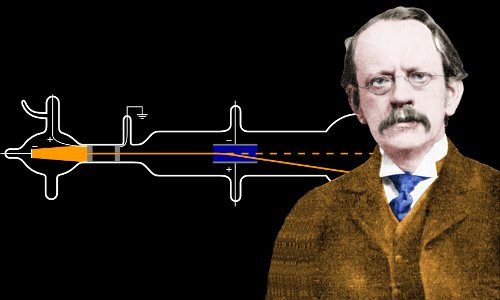
Im Jahr 1897, im Alter von 40 Jahren, führte Thomson ein heute berühmtes Experiment mit einer Kathodenstrahlröhre durch.

Eine Kathodenstrahlröhre, ähnlich der von J. J. Thomson verwendeten. In der hohlen Glasröhre wird die Luft abgepumpt, um ein Vakuum zu erzeugen. An der Kathode werden durch eine Hochspannung Elektronen erzeugt, die durch das Vakuum wandern und ein grünes Leuchten erzeugen, wenn sie am Ende auf das Glas treffen. Hier wirft ein Metallkreuz einen Schatten, der beweist, dass die Elektronen in geraden Linien unterwegs sind und nicht durch Metall wandern können. Bild von Zátonyi Sándor.
Als Thomson seine Kathodenstrahlen durch Luft statt durch das übliche Vakuum reisen ließ, war er überrascht, wie weit sie reisen konnten, bevor sie gestoppt wurden. Dies legte ihm nahe, dass die Teilchen in den Kathodenstrahlen um ein Vielfaches kleiner waren, als die Wissenschaftler die Atome eingeschätzt hatten.
So, Kathodenstrahlteilchen waren kleiner als Atome! Was ist mit ihrer Masse? Hatten sie eine Masse, die typisch für, sagen wir, ein Wasserstoffatom war? –
Um die Masse eines Kathodenstrahlteilchens abzuschätzen und herauszufinden, ob seine Ladung positiv oder negativ war, lenkte Thomson Kathodenstrahlen mit elektrischen und magnetischen Feldern ab, um zu sehen, in welche Richtung sie abgelenkt wurden und wie weit sie vom Kurs abgezogen wurden. Er wusste, dass die Größe der Ablenkung etwas über die Masse des Teilchens aussagen würde und die Richtung der Ablenkung über die Ladung, die das Teilchen trägt. Er schätzte die Masse auch, indem er die Wärmemenge maß, die die Teilchen erzeugten, wenn sie ein Ziel trafen.
Thomson benutzte eine Nebelkammer, um festzustellen, dass ein Kathodenstrahlteilchen die gleiche Menge an Ladung (d.h. eine Einheit) wie ein Wasserstoffion trägt.
Aus diesen Experimenten zog er drei revolutionäre Schlussfolgerungen:
- Kathodenstrahlteilchen sind negativ geladen.
- Kathodenstrahlteilchen sind mindestens tausendmal leichter als ein Wasserstoffatom.
- Welche Quelle auch immer zu ihrer Erzeugung verwendet wurde, alle Kathodenstrahlteilchen haben die gleiche Masse und die gleiche Ladung.
2.300 Jahre zuvor hatte Demokrit im antiken Griechenland mit seinem Verstand die Existenz von Atomen hergeleitet.
Im Jahr 1808 hatte John Dalton mit seiner Atomtheorie die Idee von Demokrit wiederbelebt.
Zu Thomsons Zeiten waren die Wissenschaftler davon überzeugt, dass Atome die kleinsten Teilchen im Universum waren, die Grundbausteine von allem.
Dieser Glaube wurde durch die Experimente von J. J. Thomson erschüttert, der die Existenz eines neuen fundamentalen Teilchens bewies, das viel kleiner als das Atom war: das Elektron. Die Welt sollte nie wieder dieselbe sein.
Physiker hatten nun einen Anreiz, subatomare Teilchen zu erforschen – Teilchen, die kleiner sind als das Atom. Seitdem versuchen sie, die Bausteine zu entdecken, aus denen die Bausteine zu entdecken, aus denen die Bausteine zu entdecken, aus denen die Bausteine zu entdecken, aus denen die Bausteine zu entdecken, aus denen die Bausteine zu entdecken, aus denen die Bausteine zu entdecken sind… der Materie.
Obwohl viele Bausteine entdeckt wurden, scheint Thomsons Elektron ein wirklich fundamentales Teilchen zu sein, das nicht weiter unterteilt werden kann.
Thomson erhielt 1906 den Nobelpreis für Physik für seine Entdeckung.

J. J. Thomson in seinem Labor beim Betrieb einer Kathodenstrahlröhre. Obwohl ein brillanter Theoretiker, ein genialer Konstrukteur von Experimenten und ein brillanter Interpret von Versuchsergebnissen, war Thomson notorisch ungeschickt im Umgang mit Laborgeräten!
 „Da die Kathodenstrahlen eine Ladung negativer Elektrizität tragen, durch eine elektrostatische Kraft abgelenkt werden, als ob sie negativ elektrifiziert wären, und auf sie eine magnetische Kraft in genau der Weise einwirkt, wie diese Kraft auf einen negativ elektrifizierten Körper einwirken würde, der sich entlang des Weges dieser Strahlen bewegt, sehe ich keinen Ausweg aus der Schlussfolgerung, dass sie Ladungen negativer Elektrizität sind, die von Materieteilchen getragen werden.“
„Da die Kathodenstrahlen eine Ladung negativer Elektrizität tragen, durch eine elektrostatische Kraft abgelenkt werden, als ob sie negativ elektrifiziert wären, und auf sie eine magnetische Kraft in genau der Weise einwirkt, wie diese Kraft auf einen negativ elektrifizierten Körper einwirken würde, der sich entlang des Weges dieser Strahlen bewegt, sehe ich keinen Ausweg aus der Schlussfolgerung, dass sie Ladungen negativer Elektrizität sind, die von Materieteilchen getragen werden.“
Das Atom als Plum Pudding
Auf der Grundlage seiner Ergebnisse erstellte Thomson sein berühmtes (aber falsches) Plum Pudding Modell des Atoms. Er stellte sich das Atom als einen gleichmäßig positiv geladenen „Pudding“ vor, in dem die Pflaumen (Elektronen) kreisen.
Erfindung des Massenspektrometers
Mit der Entdeckung des Elektrons ging Thomson auch der Erfindung eines immens wichtigen neuen Werkzeugs für die chemische Analyse entgegen – dem Massenspektrometer.
Im einfachsten Fall ähnelt ein Massenspektrometer einer Kathodenstrahlröhre, doch sein Strahl geladener Teilchen besteht nicht aus Elektronen, sondern aus positiven Ionen. Diese Ionen werden durch elektrische/magnetische Felder von einer geradlinigen Bahn abgelenkt. Das Ausmaß der Ablenkung hängt von der Masse des Ions (geringe Massen werden stärker abgelenkt) und der Ladung (hohe Ladungen werden stärker abgelenkt) ab.
Indem man Materialien ionisiert und durch ein Massenspektrometer schickt, kann man anhand der Ablenkung der Ionen auf die im Material vorhandenen chemischen Elemente schließen.
Jedes Wasserstoffatom hat nur ein Elektron
Im Jahr 1907 stellte Thomson mit verschiedenen Methoden fest, dass jedes Wasserstoffatom nur ein Elektron hat.
Entdeckung der Isotope stabiler Elemente
Obwohl Thomson das Elektron entdeckt hatte, hatten die Wissenschaftler noch einen langen Weg vor sich, um auch nur ein grundlegendes Verständnis des Atoms zu erlangen: Protonen und Neutronen waren noch nicht entdeckt worden.
Trotz dieser Hindernisse entdeckte Thomson 1912, dass stabile Elemente als Isotope existieren können. Mit anderen Worten, dass dasselbe Element mit unterschiedlichen Atommassen existieren kann.
Thomson machte diese Entdeckung, als sein Forschungsstudent Francis Aston ionisiertes Neon durch ein magnetisches und elektrisches Feld schoss – also ein Massenspektrometer benutzte – und zwei unterschiedliche Ausschläge beobachtete. Thomson schloss daraus, dass Neon in zwei Formen existiert, deren Massen unterschiedlich sind – also Isotope.
Aston erhielt 1922 den Nobelpreis für Chemie, weil er diese Arbeit fortsetzte, eine große Anzahl stabiler Isotope entdeckte und feststellte, dass alle Isotopenmassen ganzzahlige Vielfache der Masse des Wasserstoffatoms sind.
Einige persönliche Details und das Ende
Im Jahr 1890, im Alter von 33 Jahren, heiratete Thomson Rose Elizabeth Paget, eine junge Physikerin, die in seinem Labor arbeitete. Sie war die Tochter eines Medizinprofessors aus Cambridge. Das Paar hatte einen Sohn, George, und eine Tochter, Joan.
Bescheiden und bescheiden, mit einem ruhigen Sinn für Humor, sind wohl die besten Worte, um Thomsons Persönlichkeit zusammenzufassen.
Trotz seiner Bescheidenheit wurde er im Alter von 27 Jahren Cavendish-Professor für Experimentalphysik in Cambridge – eine Rolle, die zuerst James Clerk Maxwell innehatte. In seiner Rolle als Cavendish-Professor saß er bei seinen Berechnungen oft auf demselben Stuhl, auf dem einst Maxwell selbst gesessen hatte.
Neben seinen eigenen bemerkenswerten Entdeckungen ebnete Thomson auch einer beträchtlichen Anzahl anderer Wissenschaftler den Weg zu Größe. Eine bemerkenswerte Anzahl von Thomsons Forschungsmitarbeitern wurde später mit Nobelpreisen ausgezeichnet, darunter Charles T. R. Wilson, Charles Barkla, Ernest Rutherford, Francis Aston, Owen Richardson, William Henry Bragg, William Lawrence Bragg und Max Born.
Thomson war 40 Jahre alt, als Ernest Rutherford in sein Labor kam. Nach dem Treffen schrieb Rutherford über Thomson:
„Er ist sehr angenehm im Gespräch und überhaupt nicht versteinert. Was das Aussehen betrifft, so ist er ein mittelgroßer Mann, dunkel und noch recht jugendlich: Er rasiert sich, sehr schlecht, und trägt sein Haar ziemlich lang.“
31 Jahre nachdem Thomson den Nobelpreis erhalten hatte, gewann ihn sein Sohn George. George erhielt den Preis 1937 ebenfalls für seine Arbeit mit Elektronen, von denen er bewies, dass sie sich wie Wellen verhalten können.
 „Es ist eine faszinierende Tatsache, dass Vater und Sohn den eindrucksvollsten Beweis für die scheinbar widersprüchlichen Eigenschaften des Elektrons erbracht haben: der Vater den Nachweis seines Charakters als Teilchen, der Sohn den Charakter als Welle… Thomson war äußerst stolz auf den Erfolg seines Sohnes und versuchte, die neuen Ergebnisse in seine alten Überzeugungen zu assimilieren.“
„Es ist eine faszinierende Tatsache, dass Vater und Sohn den eindrucksvollsten Beweis für die scheinbar widersprüchlichen Eigenschaften des Elektrons erbracht haben: der Vater den Nachweis seines Charakters als Teilchen, der Sohn den Charakter als Welle… Thomson war äußerst stolz auf den Erfolg seines Sohnes und versuchte, die neuen Ergebnisse in seine alten Überzeugungen zu assimilieren.“
Thomson wurde 1908 zum Ritter geschlagen, als Sir J. J. Thomson.
Gärtnern war sein Hobby.
J. J. Thomson starb im Alter von 83 Jahren, am 30. August 1940. Seine Asche wurde im Kirchenschiff der Westminster Abbey beigesetzt, zusammen mit anderen Wissenschaftsgrößen wie Isaac Newton, Lord Kelvin, Charles Darwin, Charles Lyell und seinem Freund und ehemaligen Forschungsmitarbeiter Ernest Rutherford.
Autor dieser Seite: The Doc
Die Bilder der Wissenschaftler auf dieser Seite wurden von dieser Website digital erweitert und koloriert. © Alle Rechte vorbehalten.
Diese Seite zitieren
Bitte verwenden Sie das folgende MLA-konforme Zitat:
"J. J. Thomson." Famous Scientists. famousscientists.org. 27 Jul. 2015. Web. <www.famousscientists.org/j-j-thomson/>.
Veröffentlicht von FamousScientists.org
Weiteres Lesen
J. J. Thomson
A Treatise on the Motion of Vortex Rings
MacMillan and Co. London, 1883
J. J. Thomson
Notes on Recent Researches in Electricity and Magnetism
Clarendon Press, 1893
J. J. Thomson
Über Körper, die kleiner sind als Atome
Popular Science Monthly, August, 1901
J. J. Thomson
Über die Anzahl der Korpuskeln in einem Atom
Philosophical Magazine, Bd. 11, Juni 1906. S. 769-781
Max Born
Nachruf auf Sir J. J. Thomson
Proceedings of the Physical Society, 53 iii, 1942.
Abraham Pais
Niels Bohrs Zeiten: In Physics, Philosophy, and Polity
Clarendon Press, 1993.
Creative Commons Images
Cathode Ray Tube von Zátonyi Sándor, Creative Commons Attribution-Share Alike 3.0 Unported.