Google Translate – seleziona la tua lingua dalla lista qui sotto (questo aprirà una nuova pagina esterna)
العربية | català | 中文 | 中國傳統的 | français | Deutsche | עִברִית | हिंदी | bahasa Indonesia | italiano | 日本語 | 한국어 | မြန်မာ | Pilipino | Polskie | português | ਪੰਜਾਬੀ ਦੇ | Română | русский | Español | Swahili | Svensk | ไทย | Türkçe | اردو | ייִדיש | Tiếng Việt Queste traduzioni esterne sono automatiche e potrebbero non essere accurate. (Altro? Informazioni sulle traduzioni)
Introduzione

Il sacco vitellino è una prima membrana extra-embrionale che ha origine dall’endoderma ed è coperto dal mesoderma extra-embrionale. Il sacco vitellino si trova all’esterno dell’embrione collegato da un peduncolo vitellino (dotto vitellino, dotto omphalomesenterico) all’intestino medio con il quale forma una connessione continua. Il rivestimento endodermico è continuo con l’endoderma del tratto gastrointestinale. Il mesoderma extra-embrionale si differenzia per formare il sangue e i vasi sanguigni del sistema vitellino.
Nei rettili e negli uccelli, il sacco vitellino ha una funzione associata alla nutrizione. Nei mammiferi il sacco vitellino agisce come fonte di cellule germinali primordiali e di cellule del sangue.
Nota che all’inizio dello sviluppo umano (settimana 2) una struttura transitoria chiamata “sacco vitellino primitivo” si forma dallo strato dell’ipoblasto, questa è una struttura completamente diversa.
Il sacco vitellino normalmente degenera intorno al momento in cui l’ernia dell’intestino medio ritorna nella cavità peritoneale e la parete anteriore del corpo si chiude (settimana 8). La mancata degenerazione completa di questa struttura può portare a una comune anomalia intestinale, il diverticolo di Meckel. (Altro? Diverticolo di Meckel, Johann Meckel)
Link sul celoma: Introduzione | Lezione – Sviluppo della Settimana 3 | Lezione – Sviluppo del Mesoderma | Placenta – Membrane | Categoria:Cavità Celomica
1891 peritoneale | 1897 celoma umano | 1910 Celoma e Diaframma | 1924 sieroso
Alcune scoperte recenti
- Le proprietà fenotipiche e funzionali dei macrofagi embrionaliembrionale di macrofagi derivati dal sacco vitellinoPubmedParser error: L’estensione PubmedParser ha ricevuto dati XML non validi. () “I macrofagi sono ben caratterizzati come cellule immunitarie. Tuttavia, negli ultimi anni, una moltitudine di funzioni non immunitarie sono emersi molti dei quali svolgono ruoli essenziali in una varietà di processi di sviluppo. Negli animali adulti, i macrofagi derivano dai monociti circolanti che hanno origine nel midollo osseo, ma gran parte della popolazione residente nei tessuti deriva dai progenitori eritro-mieloidi (EMP) nel sacco vitellino extra-embrionale, che appaiono circa allo stesso tempo come eritroblasti primitivi. …In conclusione, abbiamo stabilito un protocollo per isolare e propagare gli EMP in vitro, abbiamo ulteriormente definito le proprietà specializzate dei macrofagi derivati dal sacco vitellino, e abbiamo identificato le interazioni EM-EC e EM-NSPC come induttori chiave della formazione dei tubi CE e della maturazione delle cellule microgliali, rispettivamente.”
- Espressione dei geni regolatori degli ormoni tiroidei nella membrana del sacco vitellino dell’embrione di pollo in via di sviluppo “Gli ormoni tiroidei (TH) sono essenziali per il corretto sviluppo di quasi tutte le strutture del corpo fin dalle prime fasi dello sviluppo, ma la tiroide embrionale non è funzionale in queste fasi. Per chiarire il ruolo del tuorlo d’uovo come fonte di TH, il contenuto di TH nel tuorlo e l’espressione dei geni regolatori di TH nella membrana del sacco vitellino sono stati valutati durante il periodo di incubazione di 21 giorni degli embrioni di pollo….Si presume che il sacco vitellino inattivi i TH contenuti abbondantemente nel tuorlo e fornisca gli ormoni all’embrione in sviluppo in concentrazioni adeguate fino alla seconda settimana di incubazione, mentre i TH possono essere attivati nella membrana del sacco vitellino nell’ultima settimana di incubazione. Inoltre, il sacco vitellino potrebbe servire come fonte di iodio per l’embrione.”
- Nuovo sviluppo della teoria del sacco vitellino nell’embriopatia diabetica: meccanismo molecolare e legame con i difetti strutturali della nascita “Il diabete mellito materno è un fattore di rischio significativo per i difetti strutturali della nascita, compresi i difetti congeniti del cuore e del tubo neurale. …Il sistema vascolare del sacco vitellino è il primo sistema a svilupparsi durante l’embriogenesi; pertanto, è il più sensibile all’iperglicemia. Le conseguenze delle lesioni del sacco vitellino includono la compromissione del trasporto dei nutrienti a causa della vasculopatia. Anche se la relazione funzionale tra la vasculopatia del sacco vitellino e i difetti strutturali alla nascita non è ancora stata stabilita, uno studio recente rivela che la qualità della vascolarizzazione del sacco vitellino è correlata inversamente ai tassi di malformazione embrionale.”

Questa tabella permette una ricerca automatica al computer del database esterno PubMed utilizzando il link di testo “Search term” elencato.
- Questa ricerca richiede ora un link manuale poiché l’estensione originale di PubMed è stata disabilitata.
- L’elenco visualizzato dei riferimenti non riflette alcuna selezione editoriale del materiale basata sul contenuto o sulla rilevanza.
- I riferimenti appaiono in questo elenco anche in base alla data di visualizzazione della pagina attuale.
I riferimenti elencati nel resto della pagina dei contenuti e nella pagina di discussione associata (elencati sotto i sottotitoli dell’anno di pubblicazione) includono una selezione editoriale basata sia sulla rilevanza che sulla disponibilità.
Altro? References | Discussion Page | Journal Searches | 2019 References | 2020 References
Termine di ricerca: Yolk Sac Development | Vitelline Duct | Meckel’s Diverticulum
Questi articoli originariamente apparivano nella tabella Some Recent Findings, ma dato che la lista è cresciuta in lunghezza sono stati spostati in questa tabella pieghevole.
Vedi anche la Discussion Page per altri riferimenti elencati per anno e References in questa pagina corrente.
- L’ematopoiesi definitiva nel sacco vitellino emerge dall’endotelio emogenico Wnt-Responsive indipendentemente dalla circolazione e dall’identità arteriosa “Le cellule staminali ematopoietiche ripopolanti adulte (HSC) emergono in basso numero nell’embrione di topo a metà gestazione da un sottogruppo di endotelio arterioso, attraverso una transizione endoteliale-ematopoietica. L’endotelio emogeno arterioso prodotto dalle CSE dipende dall’istituzione del flusso sanguigno embrionale e dall’identità arteriosa, e richiede la segnalazione di β-catenina. Specificato prima e durante la formazione di queste HSC iniziali sono migliaia di progenitori eritro-mieloidi derivati dal sacco vitellino (EMP). …Negli embrioni privi di una circolazione funzionale, gli EMP arrotondati Kit(+) emergono ancora completamente dalla vascolatura del sacco vitellino non rimodellata. Al contrario, la segnalazione canonica Wnt sembra essere un meccanismo comune che regola l’emergenza ematopoietica dall’endotelio emogenico. Questi dati illustrano l’eterogeneità nella produzione ematopoietica e la regolazione spazio-temporale dell’endotelio emogenico embrionale primario.”
- Recensione – Cellule derivate dall’epitelio celomico nella morfogenesi viscerale “Le cavità celomiche dei vertebrati sono rivestite da un mesotelio che si sviluppa dal mesoderma della piastra laterale. Durante lo sviluppo, l’epitelio celomico è uno strato cellulare molto attivo, che localmente è in grado di fornire cellule mesenchimali che contribuiscono agli elementi mesodermici di molti organi e forniscono segnali necessari al loro sviluppo. … La parete del corpo, il cuore, il fegato, i polmoni, le gonadi e il tratto gastrointestinale sono popolati da cellule derivate dall’epitelio celomico che contribuiscono ai loro tessuti connettivi e vascolari, e talvolta a tipi cellulari specializzati come le cellule stellate del fegato, le cellule interstiziali di Cajal dell’intestino o le cellule di Sertoli del testicolo.”
- Megaloblasti eritroidi embrio-fetali nella cavità celomica umana “La cavità celomica è parte del mesoderma extraembrionale, che circonda la cavità amniotica, l’embrione e il sacco vitellino nella prima gestazione. Si ritiene ora che rappresenti un’importante interfaccia di trasferimento e una riserva di nutrienti per l’embrione. La celocentesi mediante puntura transvaginale guidata da ultrasuoni offre un accesso più facile all’embrione umano precoce, a partire da 28 giorni dopo la fecondazione. Tuttavia, nonostante alcuni studi sulla sua composizione biochimica siano stati riportati, le nostre conoscenze sulla presenza di elementi cellulari e la loro qualità in questo compartimento sono ancora limitate. Qui abbiamo studiato i fluidi celomici umani campionati da 6,6 (48 giorni) a 10 settimane di gestazione, dimostrando la presenza di precursori eritroidi embrionali funzionali, cioè i megaloblasti nella cavità celomica.”
Film
|
Settimana 3 Pagina | Play Questa animazione mostra una sezione medio-sagittale del ripiegamento del disco embrionale a partire dalla terza settimana di sviluppo.
|
Cavità amniotica Pagina | Play Questa animazione mostra lo sviluppo dei celomi extra-embrionali. Si noti che come il sacco vitellino (giallo) è continuo con il midgut e si può anche seguire lo sviluppo delle regioni del tratto gastrointestinale di foregut, midgut e hindgut. |
Panoramica dello sviluppo
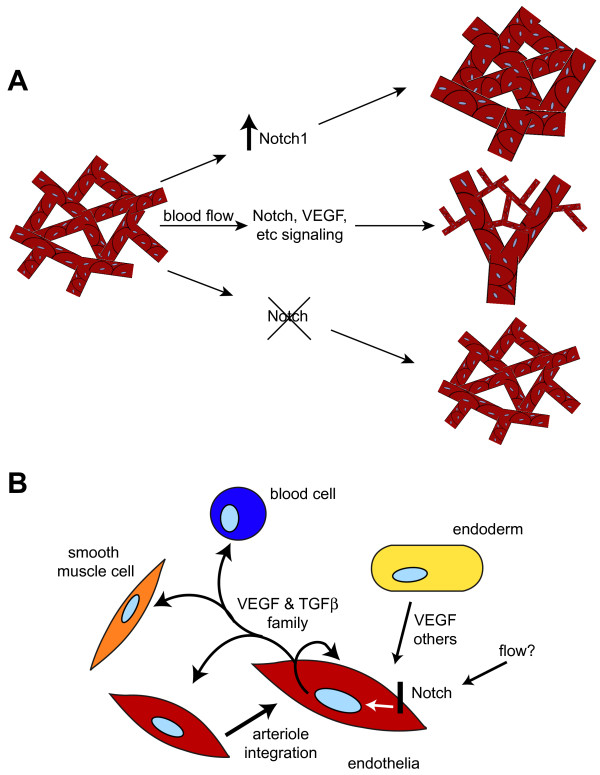
Vasi sanguigni del sacco vitellino e modello Notch
Anomalie
Diverticolo di Meckel
ICD-11 LB15.0 Diverticolo di Meckel



Questa anomalia del tratto gastrointestinale è molto comune (incidenza dell’1-2% nella popolazione generale) e deriva da un’impropria chiusura e assorbimento del dotto omphalomesenterico (dotto vitellino) nello sviluppo. Questo condotto di sviluppo transitorio collega il tuorlo al tratto gastrointestinale primitivo.
Oltre al diverticolo di Meckel ci sono una serie di altre anomalie del dotto vitellino, che dipendono dal grado, da un dotto completamente trasparente all’ombelico a residui minori (cisti, cordoni fibrosi che collegano l’ombelico all’ileo distale, tessuto di granulazione all’ombelico o ernie ombelicali).
Link: GIT Abnormalities – Meckel’s Diverticulum | OMIM – Meckel’s Diverticulum | Pubmed – Meckel’s Diverticulum | Pubmed – omphalomesenteric duct | Pubmed – vitelline duct
Yolk Sac Carcinoma
Un carcinoma del sacco vitellino (endodermal sinus tumor) è una forma di tumore delle cellule germinali.
- Too HC, Shibata M, Yayota M, Darras VM & Iwasawa A. (2017). Espressione dei geni regolatori dell’ormone tiroideo nella membrana del sacco vitellino dell’embrione di pollo in via di sviluppo. J. Reprod. Dev. , 63, 463-472. PMID: 28652559 DOI.
- Dong D, Reece EA, Lin X, Wu Y, AriasVillela N & Yang P. (2016). Nuovo sviluppo della teoria del sacco vitellino nell’embriopatia diabetica: meccanismo molecolare e collegamento ai difetti strutturali della nascita. Am. J. Obstet. Gynecol. , 214, 192-202. PMID: 26432466 DOI.
- Frame JM, Fegan KH, Conway SJ, McGrath KE & Palis J. (2016). L’emopoiesi definitiva nel sacco vitellino emerge dall’endotelio emogenico Wnt-Responsive indipendentemente dalla circolazione e dall’identità arteriosa. Cellule staminali , 34, 431-44. PMID: 26418893 DOI.
- Ariza L, Carmona R, Cañete A, Cano E & Muñoz-Chápuli R. (2016). Cellule derivate dall’epitelio celomico nella morfogenesi viscerale. Dev. Dyn. , 245, 307-22. PMID: 26638186 DOI.
- Renda MC, Giambona A, Fecarotta E, Leto F, Makrydimas G, Renda D, Damiani G, Jakil MC, Picciotto F, Piazza A, Valtieri M & Maggio A. (2010). Megaloblasti eritroidi embrio-fetali nella cavità celomica umana. J. Cell. Physiol. , 225, 385-9. PMID: 20533375 DOI.
- Copeland JN, Feng Y, Neradugomma NK, Campi PE & Vivian JL. (2011). Segnalazione Notch regola il rimodellamento e il diametro dei vasi nel sacco vitellino extraembrionale. BMC Dev. Biol. , 11, 12. PMID: 21352545 DOI.
- Damjanov I. (1980). Modello animale di malattia umana: carcinoma del sacco vitellino (tumore del seno endodermico). Am. J. Pathol. , 98, 569-72. PMID: 6986787
Reviews
Yamane T. (2018). Ematopoiesi del sacco vitellino del topo. Front Cell Dev Biol , 6, 80. PMID: 30079337 DOI.
Palis J, Malik J, McGrath KE & Kingsley PD. (2010). L’eritropoiesi primitiva nell’embrione dei mammiferi. Int. J. Dev. Biol. , 54, 1011-8. PMID: 20711979 DOI.
Tavian M & Péault B. (2005). Sviluppo embrionale del sistema ematopoietico umano. Int. J. Dev. Biol. , 49, 243-50. PMID: 15906238 DOI.
Arendt D & Nübler-Jung K. (1999). Riorganizzare la gastrulazione in nome del tuorlo: evoluzione della gastrulazione in uova amniote ricche di tuorlo. Mech. Dev. , 81, 3-22. PMID: 10330481
Auerbach R, Huang H & Lu L. (1996). Cellule staminali ematopoietiche nel sacco vitellino embrionale del topo. Cellule staminali , 14, 269-80. PMID: 8724693 DOI.
Articoli
Funayama N, Sato Y, Matsumoto K, Ogura T & Takahashi Y. (1999). Formazione del celoma: la decisione binaria del mesoderma della placca laterale è controllata dall’ectoderma. Sviluppo , 126, 4129-38. PMID: 10457021
Ricerca PubMed
Ricerca Pubmed: Coelomic Cavity Development | pericardial cavity development | pleural cavity development | peritoneal cavity development
Additional Images
Historic

Le pagine in cui appaiono i termini “Storico” (libri di testo, documenti, persone, raccomandazioni) su questo sito, e le sezioni all’interno delle pagine in cui appare questo disclaimer, indicano che il contenuto e la comprensione scientifica sono specifici del tempo della pubblicazione. Questo significa che mentre alcune descrizioni scientifiche sono ancora accurate, la terminologia e l’interpretazione dei meccanismi di sviluppo riflettono la comprensione al momento della pubblicazione originale e quelle dei periodi precedenti, questi termini, interpretazioni e raccomandazioni possono non riflettere la nostra attuale comprensione scientifica. (Altro? Storia dell’Embriologia | Documenti storici di Embriologia)
Keith A. Human Embryology and Morphology. (1902) Londra: Edward Arnold.
-

Sacco vitellino
Cullen TS. Embriologia, anatomia e malattie dell’ombelico insieme alle malattie dell’uraco. (1916) W. B. Saunders Company, Philadelphia e Londra.
-

1 embrione umano 0.7 mm
-

2 Embrione umano 1.7 mm
-

3 Embrione umano 2.5 mm
-

4 Embrione umano 3.5 mm
-

5 Embrione umano 5 mm
-

6 Embrione umano 7 mm
-

7 Embrione umano 7 mm
-

8 Embrione umano 10 mm
-

9 Embrione umano 12.5 mm
-

10 Embrione umano 10 mm

11 Embrione umano 23 mm

12 Embrione umano 3 cm

13 Embrione umano 4.5 cm sagittale
14 Embrione umano 4.5 cm
-

Placenta e feto

Lato placentare fetale

Lato materno placenta

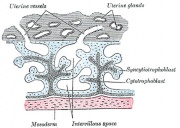
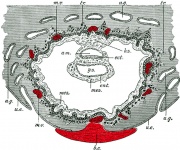
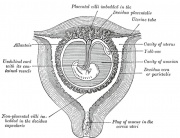
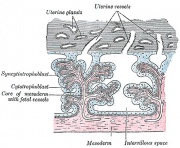
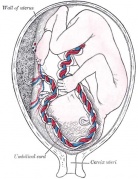


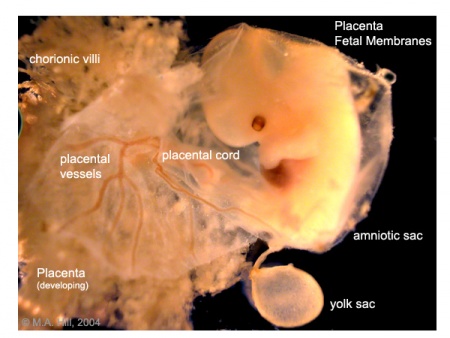
Membrana fetale e cartone animato della placenta

Placenta conversione dell’arteria spirale

Vasculatura uterina e placentare

Panoramica della circolazione fetale

Trofospongio placentare

Villi di ancoraggio della placenta

Sangue fetale sangue

Sezione trasversalesezione

Placenta_abnormalities

Placenta di topo E16.5

Placenta di topo E16.5

Placenta umana vista dal lato fetale

Corda con un’arteria e una vena

espressione genica della placenta
Termini
stelo vitellino, dotto vitellino, dotto omphalomesenterico
Link al glossario
Glossario: A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | Numeri | Simboli | Term Link
Cita questa pagina: Hill, M.A. (2021, March 25) Embryology Yolk Sac Development. Recuperato da https://embryology.med.unsw.edu.au/embryology/index.php/Yolk_Sac_Development