In termini semplicistici gli anticorpi svolgono due funzioni principali in diverse regioni della loro struttura. Mentre una parte dell’anticorpo, il frammento legante l’antigene (Fab), riconosce l’antigene, l’altra parte dell’anticorpo, nota come frammento cristallizzabile (Fc), interagisce con altri elementi del sistema immunitario, come i fagociti o i componenti della via del complemento, per promuovere la rimozione dell’antigene.
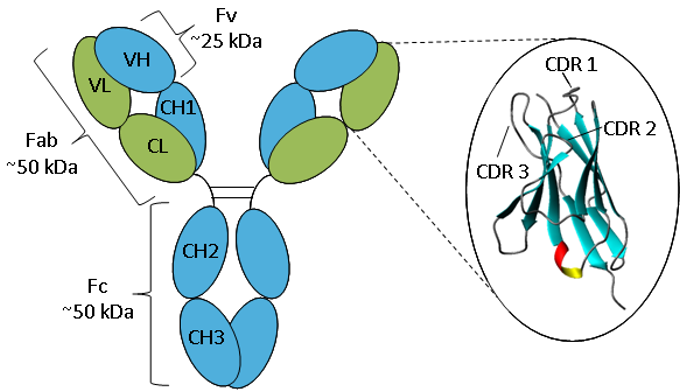
Figura. Rappresentazione schematica di un anticorpo IgG.
Un anticorpo consiste di due catene pesanti (blu) e due catene leggere (verde) piegate in domini costanti e variabili. L’ingrandimento del dominio variabile mostra una rappresentazione a nastro della struttura del foglio β e degli anelli CDR.
Gli anticorpi hanno tutti la stessa struttura di base che consiste in due catene pesanti e due leggere che formano due bracci Fab contenenti domini identici ad entrambe le estremità attaccati da una regione flessibile di cerniera al gambo dell’anticorpo, il dominio Fc, dando la classica forma a ‘Y’. Le catene si ripiegano in pieghe ripetute di immunoglobuline che consistono in fogli β antiparalleli (1), che formano domini costanti o variabili. I domini Fab sono costituiti da due domini variabili e due domini costanti, con i due domini variabili che costituiscono il frammento variabile (Fv), che fornisce la specificità antigenica dell’anticorpo (2), mentre i domini costanti fungono da struttura. Ogni dominio variabile contiene tre loop ipervariabili, noti come regioni determinanti la complementarità (CDR), distribuiti uniformemente tra quattro regioni meno variabili della struttura (FR). Sono le CDR che forniscono un sito specifico di riconoscimento dell’antigene sulla superficie dell’anticorpo e l’ipervariabilità di queste regioni permette agli anticorpi di riconoscere un numero quasi illimitato di antigeni (3).
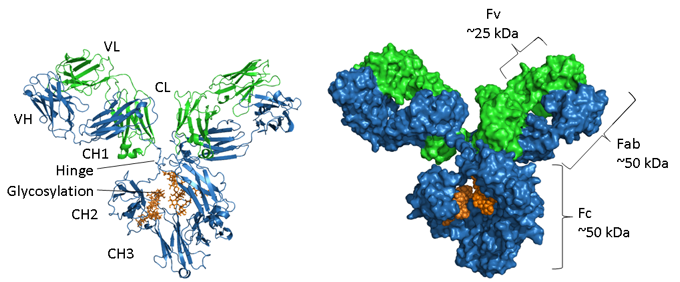 La catena pesante è mostrata in blu, la catena leggera in verde e la glicosilazione in arancione. A sinistra c’è una rappresentazione a nastro che mostra gli elementi della struttura secondaria e a destra un modello riempito di spazio della stessa molecola. Il numero di adesione PDB delle IgG1 del topo è 1IGY.
La catena pesante è mostrata in blu, la catena leggera in verde e la glicosilazione in arancione. A sinistra c’è una rappresentazione a nastro che mostra gli elementi della struttura secondaria e a destra un modello riempito di spazio della stessa molecola. Il numero di adesione PDB delle IgG1 del topo è 1IGY. Gli anticorpi sono proteine glicosilate, con la posizione e l’estensione della glicosilazione che varia tra gli isotipi. Come mostrato nell’immagine qui sopra, la regione Fc di una IgG consiste in due domini CH3 accoppiati e, al contrario, due domini CH2 che sono separati e non interagiscono ma hanno due catene di oligosaccaridi interposte tra loro. Queste catene coprono le facce idrofobiche che normalmente porterebbero all’accoppiamento dei domini. Gli N-glicani contengono una regione centrale comune di due residui di N-acetil-glucosamina (GlcNAc) legati a un’asparagina (N297 nelle IgG1 umane) tramite un legame ammidico e tre residui di mannosio. Questa struttura centrale può contenere ulteriori zuccheri terminali, come mannosio, GlcNac, galattosio, fucosio e acido sialico, generando una grande quantità di eterogeneità (4).
<< Una breve storia degli anticorpi Isotipi anticorpali & sottotipi >>
<< Panoramica degli anticorpi >>
- Poljak, R.J., Amzel, L.M., Avey, H.P., Chen, B.L., Phizackerley, R.P., e Saul, F. (1973). Struttura tridimensionale del frammento Fab’ di un’immunoglobulina umana alla risoluzione 2,8-A. Proc. Natl. Acad. Sci. U.S.A. 70, 3305-3310.
- Inbar, D., Hochman, J., and Givol, D. (1972). Localizzazione dei siti di combinazione degli anticorpi nelle porzioni variabili delle catene pesanti e leggere. Proc. Natl. Acad. Sci. U.S.A. 69, 2659-2662.
- Morea, V., Lesk, A.M., and Tramontano, A. (2000). Modellazione di anticorpi: implicazioni per l’ingegneria e la progettazione. Methods 20, 267-279.
- Wright, A., and Morrison, S.L. (1998). Effetto della struttura dei carboidrati C2-associati sulla funzione effettrice delle Ig: studi con anticorpi chimerici topo-umani IgG1 in mutanti di glicosilazione di cellule ovariche di criceto cinese. J. Immunol. 160, 3393-3402.