La legge di Beer-Lambert (chiamata anche legge di Beer) è una relazione tra l’attenuazione della luce attraverso una sostanza e le proprietà di quella sostanza. In questo post del blog, vengono prima introdotte le definizioni di trasmittanza e assorbanza della luce da parte di una sostanza, seguite da una spiegazione della legge di Beer-Lambert.
Cosa sono la trasmittanza e l’assorbanza?
Consideriamo la luce monocromatica trasmessa attraverso una soluzione; con un’intensità incidente di I0 e un’intensità trasmessa di I (Figura 1).
La trasmittanza, T, della soluzione è definita come il rapporto dell’intensità trasmessa, I, sull’intensità incidente, I0:
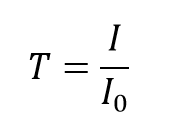
e assume valori tra 0 e 1. Tuttavia, è più comunemente espresso come percentuale di trasmittanza:
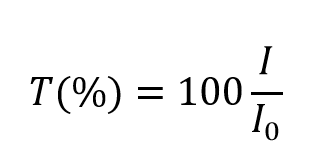
L’assorbanza, A, della soluzione è legata alla trasmittanza e alle intensità incidente e trasmessa attraverso le seguenti relazioni:
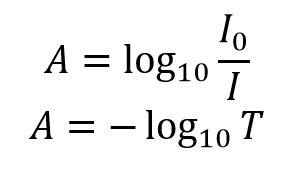
L’assorbanza ha una relazione logaritmica con la trasmittanza; con un’assorbanza di 0 corrispondente a una trasmittanza del 100% e un’assorbanza di 1 corrispondente al 10% di trasmittanza. Ulteriori valori di accoppiamenti di trasmittanza e assorbanza sono riportati nella tabella 1. Una dimostrazione visiva dell’effetto che l’assorbanza di una soluzione ha sull’attenuazione della luce che la attraversa è mostrata nella Figura 2, dove un laser da 510 nm viene fatto passare attraverso tre soluzioni di Rhodamine 6G con assorbanza diversa.
Tabella 1: Valori di assorbanza e trasmittanza:
| Assorbanza | Trasmittanza |
|---|---|
| 0 | 100% |
| 1 | 10% |
| 2 | 1% |
| 3 | 0.1% |
| 4 | 0,01% |
| 5 | 0.001% |

Figura 2: Attenuazione di un laser a 510 nm attraverso tre soluzioni di Rhodamine 6G con diversi valori di assorbanza a 510 nm. Il bagliore giallo è l’emissione di fluorescenza a ~560 nm.
L’assorbanza è una quantità adimensionale e dovrebbe, quindi, essere senza unità. Tuttavia, è abbastanza comune vedere unità di AU dichiarate dopo l’assorbanza che si dice stiano per unità arbitrarie o unità di assorbanza. Queste unità sono ridondanti e dovrebbero essere evitate. Un altro incontro comune è l’uso del termine densità ottica o OD al posto dell’assorbanza. La densità ottica è un termine più vecchio che, nel contesto della spettroscopia di assorbimento, è sinonimo di assorbanza; tuttavia, l’uso della densità ottica al posto dell’assorbanza è scoraggiato dalla IUPAC.1
Che cos’è la legge di Beer-Lambert?
La legge di Beer-Lambert è una relazione lineare tra l’assorbanza e la concentrazione, il coefficiente di assorbimento molare e il coefficiente ottico di una soluzione:

Il coefficiente di assorbimento molare è una proprietà dipendente dal campione ed è una misura di quanto il campione sia forte come assorbitore ad una particolare lunghezza d’onda della luce. La concentrazione è semplicemente le moli L-1 (M) del campione disciolto nella soluzione, e la lunghezza è la lunghezza della cuvetta usata per la misura dell’assorbanza ed è tipicamente 1 cm.
La legge di Beer-Lambert afferma che c’è una relazione lineare tra la concentrazione e l’assorbanza della soluzione, che permette di calcolare la concentrazione di una soluzione misurandone l’assorbanza. Per dimostrare questa dipendenza lineare sono state misurate cinque soluzioni di Rhodamine B in acqua utilizzando lo spettrofotometro DS5 Dual Beam (Figura 3a) e da questi spettri di assorbimento è stata creata una curva di calibrazione lineare dell’assorbanza rispetto alla concentrazione (Figura 3b). Usando questa curva di calibrazione, la concentrazione di una soluzione sconosciuta di Rhodamine B può essere determinata misurando la sua assorbanza, che è l’utilità principale della legge di Beer-Lambert.
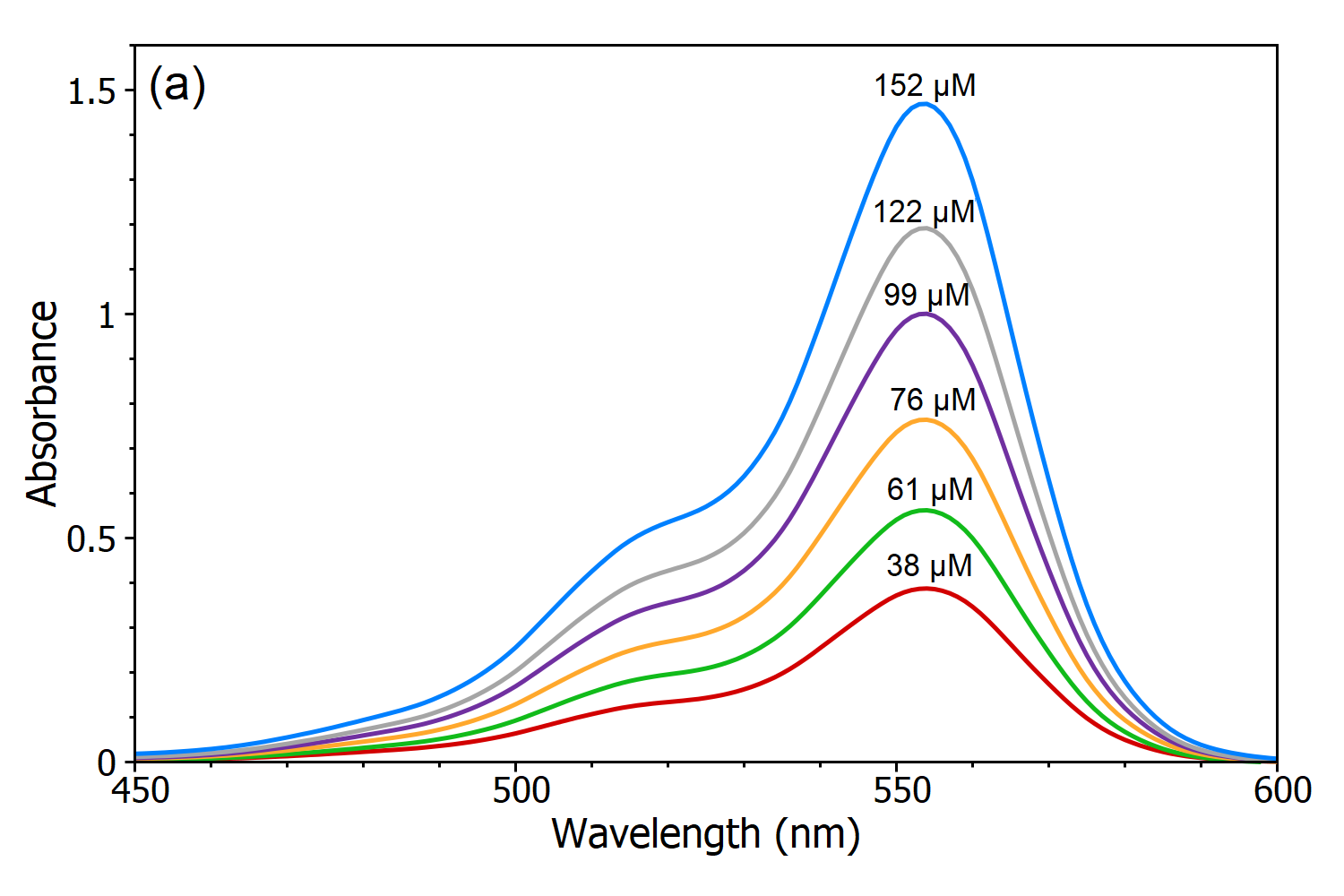

Figura 3 (a): Spettri di assorbimento di soluzioni di Rhodamine B con diverse concentrazioni in acqua misurate con lo spettrofotometro DS5 Dual Beam. (b) Curva di calibrazione della Rodamina B nell’acqua misurata a λmax.
Per maggiori informazioni sulla teoria della spettroscopia di assorbimento, consultate la sezione domande frequenti del nostro blog.