
J. J. Thomson portò la scienza a nuovi livelli con la sua scoperta del 1897 dell’elettrone, la prima particella subatomica.
Ha anche trovato la prima prova che gli elementi stabili possono esistere come isotopi e ha inventato uno degli strumenti più potenti della chimica analitica: lo spettrometro di massa.
Inizi: Scuola e Università
Joseph John Thomson nacque il 18 dicembre 1856 a Manchester, Inghilterra, Regno Unito.
Suo padre, Joseph James Thomson, gestiva una libreria specializzata che era stata nella sua famiglia per tre generazioni. Sua madre, Emma Swindells, proveniva da una famiglia che possedeva un’azienda di cotone.
Già da ragazzo, Joey, che più tardi sarebbe stato conosciuto come J. J., era profondamente interessato alla scienza. All’età di 14 anni divenne uno studente dell’Owens College, l’Università di Manchester, dove studiò matematica, fisica e ingegneria.
Un ragazzo timido, i suoi genitori speravano che diventasse un apprendista ingegnere presso una società di locomotive. Queste speranze furono deluse dalla morte di suo padre quando J.J. aveva 16 anni. Le tasse per l’apprendistato in ingegneria erano alte, e sua madre non poteva permettersele.
Questa sfortuna alla fine andò a beneficio della scienza perché J. J. aveva bisogno di trovare fondi per continuare la sua istruzione. Nel 1876, all’età di 19 anni, ottenne quel finanziamento, non in ingegneria, ma in matematica all’Università di Cambridge. Quattro anni dopo si laureò con il massimo dei voti.
Thomson continuò a studiare a Cambridge e nel 1882 vinse l’Adam’s Prize, uno dei premi di matematica più ambiti dell’università. Nel 1883 ottenne un master in matematica.
Primi lavori di ricerca
Atomi
Quando Thomson iniziò a lavorare come ricercatore nessuno aveva un’immagine chiara di come potessero essere gli atomi. Thomson decise di visualizzarli come un anello di fumo e vedere dove lo avrebbe portato la matematica che descriveva tale immagine. Questo lavoro, per il quale ricevette sia il Premio Adam che il master, aveva il titolo A Treatise on the Motion of Vortex Rings. Anche se il titolo e i capitoli iniziali potrebbero suggerire che il tema principale fosse la matematica applicata, i titoli delle sezioni finali sono rivelatori:
- Pressione di un gas. Legge di Boyle
- Effusione termica
- Schema di una teoria chimica
- Teoria della quantivalenza
- Valenza dei vari elementi
Thomson stava spingendo la sua potente mente matematica verso una comprensione più profonda della materia.
Elettricità e magnetismo
Oltre agli atomi, Thomson cominciò a interessarsi seriamente alle equazioni di James Clerk Maxwell, che avevano rivelato che l’elettricità e il magnetismo erano manifestazioni di un’unica forza – la forza elettromagnetica – e che la luce era un’onda elettromagnetica.
Nel 1893, a 36 anni, Thomson pubblicò Notes on Recent Researches in Electricity and Magnetism, basandosi sul lavoro di Maxwell. Il suo libro è talvolta descritto come “Le equazioni di Maxwell Volume 3.”
 “Mi arrischio a dare un metodo alternativo di considerare i processi che avvengono nel campo elettrico, che ho trovato spesso utile e che è, da un punto di vista matematico, equivalente alla teoria di Maxwell.”
“Mi arrischio a dare un metodo alternativo di considerare i processi che avvengono nel campo elettrico, che ho trovato spesso utile e che è, da un punto di vista matematico, equivalente alla teoria di Maxwell.”
I contributi più significativi di Thomson alla scienza
Scoperta dell’elettrone – La prima particella subatomica
Nel 1834, Michael Faraday coniò la parola ione per descrivere particelle cariche che venivano attratte da elettrodi con carica positiva o negativa. Così, ai tempi di Thomson, si sapeva già che gli atomi sono associati in qualche modo a cariche elettriche, e che gli atomi potevano esistere in forme ioniche, portando cariche positive o negative. Per esempio, il sale da cucina è fatto di atomi di sodio e cloro ionizzati.
Na+: Uno ione di sodio con una singola carica positiva
Cl-: Uno ione cloruro con una singola carica negativa
Nel 1891, George Johnstone Stoney coniò la parola elettrone per rappresentare l’unità fondamentale della carica elettrica. Tuttavia, non propose che l’elettrone esistesse come una particella a sé stante. Credeva che rappresentasse la più piccola unità di carica che un atomo ionizzato potesse avere.
Gli atomi erano ancora considerati indivisibili.
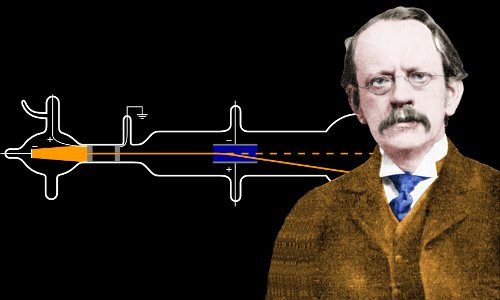
Nel 1897, a 40 anni, Thomson realizzò un esperimento ormai famoso con un tubo a raggi catodici.

Un tubo a raggi catodici, simile a quello usato da J. J. Thomson. L’aria nel tubo di vetro cavo viene pompata fuori per creare il vuoto. Gli elettroni sono prodotti al catodo da un’alta tensione e viaggiano attraverso il vuoto, creando un bagliore verde quando colpiscono il vetro alla fine. Qui una croce di metallo proietta un’ombra, stabilendo che gli elettroni viaggiano in linea retta e non possono viaggiare attraverso il metallo. Immagine di Zátonyi Sándor.
Quando Thomson permise ai suoi raggi catodici di viaggiare attraverso l’aria invece del solito vuoto, fu sorpreso di quanto lontano potessero viaggiare prima di essere fermati. Questo gli suggerì che le particelle all’interno dei raggi catodici erano molto più piccole di quanto gli scienziati avessero stimato gli atomi.
Quindi, le particelle dei raggi catodici erano più piccole degli atomi! E la loro massa? Avevano una massa tipica, per esempio, di un atomo di idrogeno? –
Per stimare la massa di una particella catodica e scoprire se la sua carica era positiva o negativa, Thomson defletteva i raggi catodici con campi elettrici e magnetici per vedere la direzione in cui venivano deflessi e quanto venivano allontanati. Sapeva che la dimensione della deflessione gli avrebbe detto la massa della particella e la direzione della deflessione gli avrebbe detto la carica che le particelle portavano. Stimò anche la massa misurando la quantità di calore che le particelle generavano quando colpivano un bersaglio.
Thomson usò una camera a nubi per stabilire che una particella catodica porta la stessa quantità di carica (cioè un’unità) di uno ione idrogeno.
Da questi esperimenti trasse tre conclusioni rivoluzionarie:
- Le particelle catodiche sono cariche negativamente.
- Le particelle catodiche sono almeno mille volte più leggere di un atomo di idrogeno.
- Qualunque fonte sia stata usata per generarle, tutte le particelle catodiche hanno la stessa massa e la stessa carica.
2.300 anni prima, nella Grecia antica, Democrito aveva usato il suo intelletto per dedurre l’esistenza degli atomi.
Nel 1808, John Dalton aveva resuscitato l’idea di Democrito con la sua teoria atomica.
All’epoca di Thomson, gli scienziati erano convinti che gli atomi fossero le particelle più piccole dell’universo, i mattoni fondamentali di ogni cosa.
Queste convinzioni furono infrante dagli esperimenti di J. J. Thomson, che provarono l’esistenza di una nuova particella fondamentale, molto più piccola dell’atomo: l’elettrone. Il mondo non sarebbe più stato lo stesso.
I fisici avevano ora un incentivo per studiare le particelle subatomiche – particelle più piccole dell’atomo. Lo hanno fatto da allora, cercando di scoprire i mattoni che costituiscono i mattoni che costituiscono i mattoni che costituiscono i mattoni che costituiscono i mattoni… della materia.
Anche se sono stati scoperti molti mattoni, l’elettrone di Thomson sembra essere una particella veramente fondamentale che non può essere ulteriormente divisa.
Thomson ricevette il premio Nobel per la fisica nel 1906 per la sua scoperta.

J. J. Thomson nel suo laboratorio con un tubo a raggi catodici. Sebbene fosse un brillante teorico, un brillante progettista di esperimenti e un brillante interprete dei risultati sperimentali, Thomson era notoriamente un po’ pigro con gli apparecchi di laboratorio! J. Thomson
“Poiché i raggi catodici portano una carica di elettricità negativa, sono deviati da una forza elettrostatica come se fossero negativamente elettrificati, e sono agiti da una forza magnetica proprio nel modo in cui questa forza agirebbe su un corpo negativamente elettrificato che si muove lungo il percorso di questi raggi, non vedo scampo alla conclusione che essi sono cariche di elettricità negativa trasportate da particelle di materia.”
L’atomo come un budino di prugne
In base ai suoi risultati, Thomson produsse il suo famoso (ma errato) modello dell’atomo. Egli immaginò l’atomo come un “budino” uniformemente carico positivamente, all’interno del quale orbitavano le prugne (elettroni).
Invenzione dello spettrometro di massa
Nella scoperta dell’elettrone, Thomson si mosse anche verso l’invenzione di un nuovo strumento immensamente importante per l’analisi chimica: lo spettrometro di massa.
Nella sua forma più semplice, uno spettrometro di massa assomiglia a un tubo catodico, ma il suo fascio di particelle cariche è composto da ioni positivi piuttosto che da elettroni. Questi ioni sono deviati da un percorso in linea retta da campi elettrici/magnetici. La quantità di deviazione dipende dalla massa dello ione (le masse basse sono deviate di più) e dalla carica (le cariche alte sono deviate di più).
Se si ionizzano i materiali e li si fa passare attraverso uno spettrometro di massa, gli elementi chimici presenti nel materiale possono essere dedotti da quanto i loro ioni vengono deviati.
Ogni atomo di idrogeno ha un solo elettrone
Nel 1907, Thomson stabilì usando una varietà di metodi che ogni atomo di idrogeno ha un solo elettrone.
Scoperta degli isotopi degli elementi stabili
Anche se Thomson aveva scoperto l’elettrone, gli scienziati avevano ancora molta strada da fare per raggiungere anche solo una comprensione di base dell’atomo: protoni e neutroni dovevano ancora essere scoperti.
Nonostante questi ostacoli, nel 1912 Thomson scoprì che gli elementi stabili potevano esistere come isotopi. In altre parole, lo stesso elemento poteva esistere con masse atomiche diverse.
Thomson fece questa scoperta quando il suo studente di ricerca Francis Aston sparò del neon ionizzato attraverso un campo magnetico ed elettrico – cioè usò uno spettrometro di massa – e osservò due distinte deviazioni. Thomson concluse che il neon esiste in due forme le cui masse sono diverse, cioè gli isotopi.
Aston vinse il premio Nobel per la chimica nel 1922 per aver continuato questo lavoro, scoprendo un gran numero di isotopi stabili e scoprendo che tutte le masse degli isotopi sono multipli interi della massa dell’atomo di idrogeno.
Alcuni dettagli personali e la fine
Nel 1890, a 33 anni, Thomson sposò Rose Elizabeth Paget, una giovane fisica che lavorava nel suo laboratorio. Era la figlia di un professore di medicina di Cambridge. La coppia ebbe un figlio, George, e una figlia, Joan.
Humble e modesto, con un tranquillo senso dell’umorismo, sono probabilmente le parole migliori per riassumere la personalità di Thomson.
Nonostante la sua modestia, all’età di 27 anni divenne Cavendish Professor di fisica sperimentale a Cambridge – un ruolo ricoperto per la prima volta da James Clerk Maxwell. Nel suo ruolo di Cavendish Professor, spesso sedeva a fare calcoli proprio sulla sedia che Maxwell stesso aveva occupato una volta.
Oltre a fare lui stesso delle scoperte notevoli, Thomson aprì la strada verso la grandezza a un numero significativo di altri scienziati. Un numero notevole di ricercatori di Thomson ha vinto il premio Nobel, tra cui Charles T. R. Wilson, Charles Barkla, Ernest Rutherford, Francis Aston, Owen Richardson, William Henry Bragg, William Lawrence Bragg e Max Born.
Thomson aveva 40 anni quando Ernest Rutherford arrivò al suo laboratorio. Dopo l’incontro, Rutherford scrisse di Thomson:
“È molto piacevole nella conversazione e non è affatto fossilizzato. Per quanto riguarda l’aspetto è un uomo di media grandezza, scuro e abbastanza giovane ancora: si rade, molto male, e porta i capelli piuttosto lunghi.”
31 anni dopo che Thomson ricevette il premio Nobel lo vinse suo figlio George. Anche il premio di George del 1937 fu per il lavoro con gli elettroni, che dimostrò che possono comportarsi come onde.
 “È un fatto affascinante che padre e figlio abbiano dato la prova più eclatante delle proprietà apparentemente contraddittorie dell’elettrone: il padre dimostrando il suo carattere di particella, il figlio il suo carattere di onda… Thomson era estremamente orgoglioso del successo del figlio e cercò di assimilare i nuovi risultati alle sue vecchie convinzioni.”
“È un fatto affascinante che padre e figlio abbiano dato la prova più eclatante delle proprietà apparentemente contraddittorie dell’elettrone: il padre dimostrando il suo carattere di particella, il figlio il suo carattere di onda… Thomson era estremamente orgoglioso del successo del figlio e cercò di assimilare i nuovi risultati alle sue vecchie convinzioni.”
Thomson fu nominato cavaliere nel 1908, diventando Sir J. J. Thomson.
Il giardinaggio era il suo hobby.
J. J. Thomson morì all’età di 83 anni, il 30 agosto 1940. Le sue ceneri furono sepolte nella navata dell’Abbazia di Westminster, unendosi ad altri grandi della scienza come Isaac Newton, Lord Kelvin, Charles Darwin, Charles Lyell, e il suo amico ed ex ricercatore Ernest Rutherford.
Autore di questa pagina: The Doc
Immagini di scienziati in questa pagina migliorate digitalmente e colorate da questo sito web. © Tutti i diritti riservati.
Cita questa pagina
Si prega di utilizzare la seguente citazione conforme agli standard MLA:
"J. J. Thomson." Famous Scientists. famousscientists.org. 27 Jul. 2015. Web. <www.famousscientists.org/j-j-thomson/>.
Pubblicato da FamousScientists.org
Altre letture
J. J. Thomson
A Treatise on the Motion of Vortex Rings
MacMillan and Co. London, 1883
J. J. Thomson
Notes on Recent Researches in Electricity and Magnetism
Clarendon Press, 1893
J. J. Thomson
Sui corpi più piccoli degli atomi
Popular Science Monthly, agosto 1901
J. J. Thomson
Sul numero di corpuscoli in un atomo
Rivista filosofica, vol. 11, giugno 1906. p. 769-781
Max Born
Avviso necrologico di Sir J. J. Thomson
Proceedings of the Physical Society, 53 iii, 1942.
Abraham Pais
I tempi di Niels Bohr: In Physics, Philosophy, and Polity
Clarendon Press, 1993
Creative Commons Images
Cathode Ray Tube by Zátonyi Sándor, Creative Commons Attribution-Share Alike 3.0 Unported.