In senso stretto, la ionizzazione è la perdita completa di un elettrone da una specie atomica o molecolare.

Nelle equazioni chimiche, la carica degli ioni è indicata come apice, come in questa semplice reazione di ionizzazione:
Gli ioni possono ionizzare ulteriormente:
Gli ioni con carica positiva sono spesso chiamati cationi.
Anche se in termini rigorosi la ionizzazione si riferisce alla formazione di uno ione positivo, nell’uso normale, la parola include anche la formazione di uno ione negativo:
Gli ioni carichi negativamente sono spesso indicati come anioni.
Ionizzazione diretta degli elementi
I metalli formano tipicamente cationi e i non-metalli formano tipicamente anioni.Alcuni elementi, come il carbonio, l’oro e i gas nobili, non formano facilmente ioni.
I metalli alcalini nel gruppo 1 della tavola periodica e gli alogenuri nel gruppo 17 si ionizzano molto facilmente. I metalli alcalini hanno bisogno di perdere solo un elettrone per ottenere un guscio completo di elettroni: allo stesso modo, gli alogenuri hanno bisogno di guadagnare solo un elettrone per ottenere questo.Per esempio, il sodio e il cloro reagiscono spontaneamente ionizzandosi per formare il composto ionico cloruro di sodio:
Potassio e acqua reagiscono ionizzandosi per produrre il composto ionico idrossido di potassio più idrogeno:
Ionizzazione di molecole in soluzione
Le molecole di gas cloruro di idrogeno si ionizzano facilmente in acqua per produrre acido cloridrico.
Auto-ionizzazione
In acqua, esiste un equilibrio tra le molecole di acqua e gli ioni risultanti dall’autoionizzazione dell’acqua. (Vedi anfiprotica.)
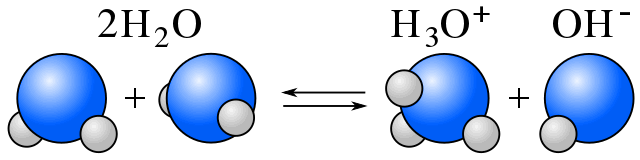
Ionizzazione nel plasma
A temperature molto alte, gli elettroni sono strappati dagli atomi per formare un plasma.Per esempio, nella corona del sole:
L’energia richiesta per rimuovere un elettrone da una specie è la sua energia di ionizzazione.
Esempi di energia di ionizzazione
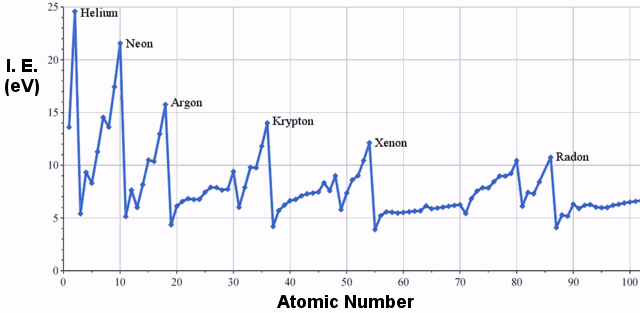
Le energie di prima ionizzazione degli elementi della terza fila della tavola periodica sono le seguenti:
Energia di prima ionizzazione
| Elemento | Energia di prima ionizzazione (eV) |
|---|---|
| Sodio | 5.14 |
| Magnesio | 7.65 |
| Alluminio | 5.99 |
| Silicio | 8.15 |
| Fosforo | 10,49 |
| Zolfo | 10,36 |
| Cloro | 12,97 |
| Argon | 15.76 |
C’è chiaramente una tendenza all’aumento dell’energia di ionizzazione da sinistra a destra nella tavola periodica.Il grafico qui sotto illustra questa tendenza per una più ampia selezione di elementi: