L’insufficienza cardiaca acuta scompensata (ADHF) rimane uno dei motivi più comuni di ospedalizzazione. I pazienti ADHF che hanno condizioni co-morbide presentano sfide ostinate per gli ospedalieri. E l’ADHF si osserva frequentemente in pazienti di 65 anni e più. L’attivazione neuro-ormonale che risulta come conseguenza della disfunzione miocardica porta a un progressivo deterioramento cardiaco e a disturbi emodinamici che alla fine si manifestano come insufficienza cardiaca acuta scompensata.
Gli obiettivi della gestione dell’ADHF includono la stabilizzazione del paziente, la gestione delle anomalie emodinamiche acute, l’inversione dei sintomi della dispnea causata dal sovraccarico di liquidi e l’inizio di terapie basate sull’evidenza per ridurre la progressione della malattia e migliorare la sopravvivenza.
In questo articolo presentiamo il caso di una donna di 26 anni con ADHF ed evidenziamo le strategie di gestione che possono portare alla stabilizzazione e al miglioramento dell’esito a lungo termine.
 clicca per la versione grande
clicca per la versione grande
Figura 1. RA = pressioni atriali destre, PCWP = pressione di cuneo capillare polmonare
Introduzione
Nonostante i grandi progressi nel trattamento delle malattie cardiache, l’insufficienza cardiaca rimane un problema di salute pubblica di proporzioni epidemiche negli Stati Uniti. Circa cinque milioni di americani sono affetti da insufficienza cardiaca e ogni anno la malattia viene diagnosticata a più di 550.000 pazienti.1 Il numero annuale di ricoveri per insufficienza cardiaca come diagnosi primaria è aumentato da circa 810.000 nel 1990 a più di 1 milione nel 1999, ed è il gruppo più comune di diagnosi di dimissione per i pazienti dai 65 anni in su.2 Medicare ha speso più dollari per la diagnosi e il trattamento dello scompenso cardiaco che per qualsiasi altra diagnosi – più di 27,9 miliardi di dollari nel 2005.1
I pazienti che si presentano al dipartimento di emergenza (ED) con ADHF sono spesso emodinamicamente instabili, con gravi sintomi di dispnea e sovraccarico di liquidi. Una valutazione rapida e l’inizio tempestivo di interventi appropriati sono necessari per raggiungere la stabilità clinica e prevenire una prolungata degenza ospedaliera se è necessario il ricovero. Il tasso di mortalità in ospedale per l’ADHF è del 5%-8%; la durata mediana dell’ospedalizzazione è di cinque giorni e il tasso di riospedalizzazione a sei mesi è di circa il 50%.1,3 Pertanto, è chiaro che un migliore riconoscimento e trattamento sono di fondamentale importanza. Con questi obiettivi in mente, presentiamo un caso recente che evidenzia molte delle preoccupazioni e delle opzioni di trattamento dell’ADHF.
 clicca per la versione grande
clicca per la versione grande
Figura 1. RA = pressioni atriali destre, PCWP = pressione di incuneamento capillare polmonare
Presentazione del caso
Karen A. è una donna nera di 26 anni con malattia di Hodgkin in stadio III, diagnosticata nel 2000. Ha ricevuto la chemioterapia (cisplatino, citarabina, doxorubicina, rituxan, gemcitabina) e, di conseguenza, nel 2001 ha sviluppato una cardiomiopatia indotta dalla chemioterapia con una frazione di eiezione del <20%. Le sue condizioni si sono stabilizzate e lei è rimasta in remissione clinica fino al settembre 2002.
Nel 2003 ha ricevuto un trapianto autologo di cellule staminali e successivamente si è presentata all’ED con lamentele di affaticamento, progressiva mancanza di respiro nei sette giorni precedenti ed edema degli arti inferiori. Ha anche riferito un dolore pleuritico al petto sul lato destro, ma ha negato nausea, vomito o diaforesi associati. Nei tre giorni precedenti l’ammissione, aveva guadagnato 10 libbre. Negli ultimi sei mesi, aveva avuto diversi ricoveri per ADHF.
Il suo esame fisico ha rivelato una donna vigile e obesa in moderata difficoltà respiratoria con membrane mucose secche. I suoi segni vitali indicavano una temperatura di 36,5° C, una frequenza cardiaca di 110 battiti al minuto, una frequenza respiratoria di 20 respiri al minuto, una pressione sanguigna di 111/73 mm Hg e una saturazione di ossigeno del 92%. Non aveva ittero sclerale, ma aveva distensione venosa giugulare fino all’angolo della mandibola a 45° in posizione verticale. Il suo esame cardiaco ha indicato una tachicardia con suoni cardiaci distanti e un terzo suono cardiaco udibile (S3), così come un mormorio di eiezione sistolica di grado 2/6 al bordo sternale sinistro. Il suo esame polmonare ha dimostrato crepitii diffusi presenti in entrambi i campi polmonari, ma nessun rantolo. L’esame addominale era notevole per la tenerezza alla palpazione nella regione ipogastrica destra e per l’epatomegalia, la sua pelle era calda e asciutta senza cianosi, e le sue estremità mostravano un significativo edema pretibiale bilaterale fino alle ginocchia.
 clicca per la versione grande
clicca per la versione grande
Figura 1. RA = pressioni atriali destre, PCWP = pressione di cuneo capillare polmonare
I suoi farmaci attuali includevano:
- Furosemide, 60 mg per bocca due volte al giorno;
- Carvedilolo, 12.5 mg per bocca al mattino, 6,25 mg la sera;
- Amiodarone, 200 mg per bocca al giorno; e
- Digoxin, 0,125 mg per bocca al giorno.
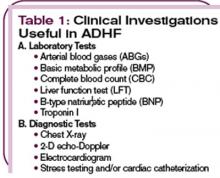
I risultati di laboratorio includevano elettroliti normali, azoto ureico nel sangue e creatinina nel siero. La sua emoglobina era 11.3 gm/L, e il suo livello di peptide natriuretico di tipo B (BNP) era 4.837 pg/ml. Gli enzimi cardiaci iniziali erano negativi (troponina I di <0. 03).
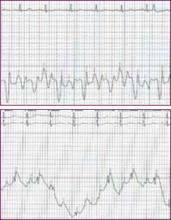
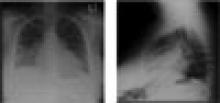
La sua radiografia del torace ha dimostrato un ingrandimento cardiaco moderato con ispessimento bilaterale delle linee del setto subpleurico e offuscamento della vascolarizzazione polmonare coerente con lo sviluppo di edema polmonare cardiogeno. Un elettrocardiogramma a 12 derivazioni ha indicato una tachicardia sinusale con una frequenza di 110 battiti al minuto e cambiamenti non specifici dell’onda ST-T nelle derivazioni inferiori, ma non sono state notate onde Q. L’ecocardiografia ha mostrato una funzione sistolica ventricolare sinistra gravemente ridotta con grave ipocinesi globale del ventricolo sinistro e una frazione di eiezione misurata del 25%-30%. Non c’era effusione pericardica.
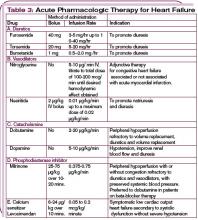
È stata ricoverata al piano di telemetria con la diagnosi di ADHF. È stata messa sotto ossigeno supplementare e sottoposti a enzimi cardiaci in serie, e il suo elettrocardiogramma è rimasto negativo per lesioni o ischemia. La furosemide endovenosa è stata iniziata a 40 mg ogni 12 ore. Dopo 24 ore, le è stato dato un bolo di nesiritide (2 mcg/kg), seguito da un’infusione continua a 0,01 mcg/kg/min. I farmaci cardiaci sono stati continuati, e il dosaggio del carvedilolo è stato ridotto a 6,25 mg per bocca due volte al giorno.
Dopo un periodo di diuresi, la paziente è rimasta altamente sintomatica; quindi, è stato fatto un cateterismo del cuore destro. L’emodinamica indicava una portata cardiaca di tre litri al minuto, una pressione atriale destra di 20 mm Hg, una pressione ventricolare destra di 70/20 mm Hg, una pressione dell’arteria polmonare di 66/20 mm Hg con una pressione media di 52 mm Hg, e una pressione del cuneo capillare polmonare di 25 mm Hg. (Vedi figure 1 e 2, pag. 23).
Nelle 24 ore successive, il paziente ha avuto più di tre litri di urina in uscita ed è migliorato significativamente. L’infusione di nesiritide è stata interrotta dopo 48 ore di terapia e il paziente è stato svezzato dall’ossigeno supplementare. Il lisinopril è stato iniziato a 2,5 mg al giorno per bocca. Il quarto giorno di ospedale, il paziente camminava intorno alla stazione delle infermiere senza ossigeno supplementare, ed è stato restituito alla dose precedente di furosemide, 60 mg due volte al giorno.
Il paziente è stato iscritto nel programma di successo del cuore (HSP), un programma interdisciplinare collaborativo che è disponibile nell’istituzione per i pazienti con cancro con insufficienza cardiaca. Le è stato fornito del materiale di educazione del paziente che includeva videocassette educative sulla gestione dell’insufficienza cardiaca, il monitoraggio quotidiano del peso, la dieta, i farmaci, l’esercizio fisico e gli aspetti emotivi dell’insufficienza cardiaca. Gli infermieri con formazione sull’insufficienza cardiaca erano disponibili a rispondere alle domande del paziente e a fornire ulteriori istruzioni per il follow-up dopo la dimissione del paziente. La paziente è migliorata abbastanza da essere in grado di iscriversi in una New York Heart Association (NYHA) classe II ed è stata dimessa dopo cinque giorni, con un appuntamento di follow-up all’ambulatorio una settimana dopo la dimissione dall’ospedale.
Discussione
Questo caso illustra le sfide inerenti alla diagnosi e alla gestione dell’ADHF in un paziente con cancro con una storia nota di insufficienza cardiaca. La valutazione rapida è fondamentale per stabilire una diagnosi e iniziare un intervento appropriato. Gli obiettivi della gestione di ADHF rimangono gli stessi indipendentemente dall’eziologia. Questi includono la stabilizzazione del paziente, la gestione delle anomalie emodinamiche acute, l’inversione dei sintomi della dispnea causata dal sovraccarico di liquidi e l’avvio di terapie basate sull’evidenza per diminuire la progressione della malattia e migliorare la sopravvivenza. Gli stessi principi si applicano anche se il paziente ha una comorbilità importante come il cancro, e il sospetto per la diagnosi deve rimanere alto.
Valutazione iniziale
La diagnosi precoce e la gestione efficace delle ADHF sono di fondamentale importanza, poiché è stato dimostrato che riducono le ospedalizzazioni e i ricoveri in unità di terapia intensiva, diminuiscono la durata della degenza e il costo del ricovero.4 Un’anamnesi e un esame fisico completi devono essere eseguiti per identificare i segni e i sintomi che portano a una diagnosi di insufficienza cardiaca.
Dobbiamo valutare potenziali fattori di rischio come la storia di ipertensione, dislipidemia, diabete mellito, malattia coronarica, malattia valvolare, malattia vascolare periferica, una storia familiare di cardiomiopatia, fumo, uso di alcol, problemi alla tiroide, apnea del sonno, e qualsiasi storia recente di infezione (in particolare infezione del tratto respiratorio superiore, che può causare cardiomiopatia virale).
Come parte di ulteriori indagini con i pazienti affetti da cancro, includere la possibile esposizione passata del paziente ad agenti cardiotossici (ad es, antracicline, trastuzumab, ciclofosfamide ad alte dosi) o irradiazione mediastinica. La cardiomiopatia indotta dalla chemioterapia sta diventando sempre più un problema nella gestione dell’insufficienza cardiaca a causa del numero crescente di sopravvissuti al cancro a lungo termine che hanno ricevuto un trattamento con chemioterapia contenente antracicline o altre terapie aggressive.
Focalizzare il volume e lo stato di perfusione durante la valutazione fisica di ogni paziente. La maggior parte dei pazienti che si presentano al pronto soccorso con uno scompenso acuto sono in sovraccarico di volume. Il sovraccarico di volume si manifesta con sintomi di dispnea, ortopnea e dispnea parossistica notturna, nonché con distensione venosa giugulare, reflusso epatogiugulare, ascite, edema e crepitii nei polmoni.5 I crepitii non sono sempre presenti nei pazienti con insufficienza cardiaca cronica, tuttavia, a causa del continuo movimento di liquido nell’interstizio associato all’aumento del drenaggio linfatico, lasciando gli alveoli relativamente asciutti.6
Oltre a un’anamnesi completa e all’esame fisico, diversi test aiuteranno a stabilire la diagnosi. Una misurazione del peptide natriuretico di tipo B (BNP) facilita la diagnosi di ADHF. Il BNP è un peptide natriuretico generato endogenamente che si attiva in risposta all’espansione atriale o ventricolare dovuta al sovraccarico di volume e all’aumento della tensione di parete.7,8 I livelli circolanti di BNP endogeno sono significativamente elevati nei pazienti con ADHF e sono uno strumento prezioso per la diagnosi di insufficienza cardiaca al pronto soccorso.9-11 In Karen A., il livello di BNP era 4.837 pg/mL, che è indicativo di insufficienza cardiaca di stadio D. Questa diagnosi è stata confermata dai risultati della radiografia del torace di edema polmonare cardiogeno nel contesto di grave ipocinesi ventricolare sinistra e una frazione di eiezione del 25%-30%.
Anamnesi ed esame fisico possono fornire indizi importanti per quanto riguarda l’anomalia cardiaca sottostante, ma sono necessari test invasivi e non invasivi per fornire una diagnosi definitiva di insufficienza cardiaca e per valutare potenziali condizioni aggravanti. Un ecocardiogramma bidimensionale con studio del flusso Doppler è un test diagnostico essenziale per valutare la contrattilità miocardica o la frazione di eiezione. L’ecocardiogramma può anche valutare altri componenti strutturali come il pericardio, lo stato valvolare e i parametri emodinamici che possono contribuire allo sviluppo di ADHF. Nei pazienti con fattori di rischio cardiaco, un test di perfusione miocardica da sforzo o un cateterismo possono identificare la presenza di coronaropatia come contributore.
Un elettrocardiogramma a 12 derivazioni è necessario per stabilire il ritmo e per mostrare prove di infarto miocardico acuto o precedente, pericardite, anomalie di conduzione o ipertrofia ventricolare sinistra come risultato di una prolungata ipertensione non controllata. È noto che i disturbi del ritmo come la fibrillazione atriale possono essere un fattore precipitante per l’ADHF.
Una radiografia del torace è necessaria per scoprire l’edema polmonare nei casi di sovraccarico di liquidi e per mostrare una silhouette cardiaca allargata nei casi di cardiomiopatia dilatata. L’identificazione di una o più cause definitive che precipitano l’insorgenza dell’ADHF è cruciale per elaborare un piano di gestione e iniziare un intervento appropriato. (Vedi Tabella 2, pag. 22.)
 clicca per la versione grande
clicca per la versione grande
Figura 1. RA = pressioni atriali destre, PCWP = pressione di incuneamento capillare polmonare
Gestione immediata delle ADHF
Esistono linee guida di pratica clinica recentemente sviluppate per la gestione delle ADHF, ma la gestione è ancora basata in gran parte sull’evidenza empirica.12 Iniziare il trattamento delle ADHF al pronto soccorso con diuretici per via endovenosa (salvo controindicazioni). La maggior parte dei pazienti con ADHF risponderà ai soli diuretici.13 Se il paziente risponde male ai diuretici, l’uso di nesiritide insieme ai diuretici si è dimostrato vantaggioso, come dimostra l’analisi dei dati del registro ADHERE che indica che i pazienti trattati con nesiritide per via endovenosa avevano un tasso di mortalità ospedaliera inferiore rispetto ai pazienti trattati con milrinone o dobutamina.14 Altre opzioni includono l’ultrafiltrazione, un intervento che è stato notato per ridurre la durata della degenza e i tassi di riospedalizzazione nei pazienti con ADHF.
Nesiritide è una forma ricombinante di BNP senza effetti inotropi diretti ma con proprietà vasodilatatorie venose, arteriose e coronariche che possono migliorare i sintomi nell’ADHF.15 Il dosaggio consigliato per la nesiritide è un bolo IV di 2 mcg per kg, seguito da un’infusione continua di 0,01 mcg/kg/min. In caso di ipotensione con una pressione sanguigna sistolica inferiore a 100 mm Hg, tuttavia, una dose iniziale in bolo IV non è raccomandata; invece, il paziente può iniziare con un’infusione continua di 0,01 mcg/kg/min, o considerare altre terapie.
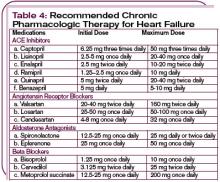
In pazienti emodinamicamente instabili con una pressione sanguigna sistolica inferiore a 90 mm Hg, o in quelli con evidenza di ipoperfusione degli organi finali (shock cardiogeno), il supporto inotropo può essere considerato fino alla stabilizzazione del paziente. (Vedi Tabella 3, pag. 22.) Riconoscere che gli agenti inotropi hanno effetti avversi sul sistema neuro-ormonale e non sono raccomandati di routine, ma possono essere essenziali per la stabilizzazione temporanea. (Per saperne di più sulla gestione farmacologica dell’ADHF, vedi Tabella 4, p. 24.)
 clicca per la versione grande
clicca per la versione grande
Figura 2. Radiografie del torace posteroanteriori e laterali che mostrano infiltrati basilari e una silhouette cardiaca allargata
Gestione subacuta dell’ADHF
Una volta che lo scompenso acuto è stato invertito e uno stato euvolemico è stato raggiunto, passare la terapia a una combinazione di tre classi di farmaci: diuretici, inibitori dell’enzima di conversione dell’angiotensina (ACE) e beta-bloccanti, salvo controindicazioni. I benefici di questi farmaci sono stati stabiliti dall’evidenza di numerosi studi clinici su larga scala.3,12
Iniziare gli ACE inibitori in tutti i pazienti con insufficienza cardiaca dovuta a disfunzione sistolica ventricolare sinistra (a meno che non sia controindicato o se il paziente è intollerante).3 Dare ACE-I ai pazienti che hanno avuto un recente episodio di ADHF, insieme a diuretici per mantenere l’equilibrio del sodio e per prevenire l’edema periferico e polmonare. Gli ACE-inibitori sono controindicati per i pazienti che sono incinte e per quelli con potenziale di gravidanza, così come per gli individui con una storia precedente di angioedema o insufficienza renale dopo aver ricevuto il farmaco. Istruire i pazienti di evitare qualsiasi cambiamento improvviso di posizione, in quanto possono sperimentare ipotensione ortostatica durante l’assunzione di ACE inibitori.
Alcuni pazienti sono intolleranti agli ACE inibitori a causa di una tosse persistente che si verifica in circa il 5% al 10% dei pazienti caucasici e fino al 50% dei pazienti cinesi.16 I bloccanti del recettore dell’angiotensina (ARB) sono un’alternativa consolidata.17 Due ARB (candesartan e valsartan) sono raccomandati per il trattamento dell’insufficienza cardiaca sulla base delle evidenze di studi clinici controllati.17,18 Questi farmaci hanno dimostrato una riduzione delle ospedalizzazioni e il candesartan, se usato come alternativa all’ACE-I, ha dimostrato di ridurre la mortalità. Inoltre, in pazienti con evidenza di disfunzione ventricolare sinistra dopo infarto miocardico, il valsartan ha fornito un beneficio che non era inferiore agli ACE-inibitori.17
Iniziare i beta-bloccanti a dosi molto basse e aumentare gradualmente come tollerato. Monitorare attentamente i pazienti per i sintomi di ipotensione, aumento di peso significativo, ritenzione di liquidi, bradicardia e blocco cardiaco. Inoltre, informare i pazienti che possono sperimentare affaticamento generalizzato o debolezza con l’inizio di beta-bloccanti. In un paziente con cancro è difficile distinguere tra la fatica causata dalla malattia e gli effetti collaterali della terapia. La fatica associata alla terapia con beta-bloccanti di solito si risolve spontaneamente entro pochi giorni. Un antagonista dell’aldosterone, come lo spironolattone o l’eplerenone, somministrato alla dose giornaliera di 12,5-25 mg in aggiunta alla terapia standard, blocca efficacemente gli effetti dell’aldosterone (studio RALES) per ottenere un blocco neuro-ormonale completo.19 Quando si prescrive un antagonista dell’aldosterone, specialmente in combinazione con ACE inibitori e diuretici dell’ansa, è importante monitorare i livelli sierici di potassio perché questa combinazione può provocare iperkaliemia.
 clicca per la versione grande
clicca per la versione grande
clicca per la versione grande
Programmi di gestione della malattia
La gestione completa dello scompenso cardiaco non si limita solo alle cure ospedaliere durante un episodio di ADHF. Al fine di prevenire ripetuti ricoveri, implementare misure aggiuntive attraverso programmi formali di gestione della malattia. Questi programmi di gestione della malattia sono spesso diretti o coordinati da infermieri di pratica avanzata che si occupano della cura completa dei pazienti affetti da insufficienza cardiaca con particolare attenzione all’educazione e alla consulenza del paziente per migliorarne la compliance.20
Le strategie di trattamento non farmacologico sottolineate nei programmi di gestione della malattia si sono dimostrate efficaci nel raggiungere risultati positivi. Queste comprendono la consulenza ai pazienti sulla gestione della dieta, compresa la promozione di una dieta con due grammi di sodio, la restrizione dell’alcol e un’adeguata integrazione della perdita di elettroliti dovuta ai diuretici. Tenere un diario del peso giornaliero del paziente a casa e portarlo alle visite in ufficio aiuterà sia il paziente che il medico a monitorare la ritenzione di liquidi in modo efficiente.
L’ipotensione è un effetto collaterale comune della terapia farmacologica per l’insufficienza cardiaca. Impiegare un’educazione completa sia con il paziente che con la famiglia per evitare un’inutile sospensione dei farmaci. Una pressione sanguigna sistolica di 90 mm Hg è accettabile finché non ci sono sintomi associati di vertigini o sincope.
Incoraggiare le linee guida di attività, compresa la partecipazione a programmi di esercizio. La partecipazione alle riunioni del gruppo di sostegno fornirà un luogo in cui i pazienti possono condividere problemi e preoccupazioni comuni con altri in situazioni simili. Una o due settimane dopo la dimissione dall’ospedale, programmare un follow-up ambulatoriale in una clinica per l’insufficienza cardiaca, dove l’educazione all’insufficienza cardiaca viene rafforzata per prevenire un altro episodio di ricovero per ADHF.
Sommario
Nonostante le sfide aggiuntive, la gestione dell’ADHF in un paziente con una grave comorbidità come il cancro comporta gli stessi obiettivi del trattamento dell’ADHF in qualsiasi altro paziente. Con una valutazione rapida e un intervento appropriato, il paziente ha le migliori possibilità di sopravvivenza. TH
Gli autori lavorano presso l’Università del Texas M.D. Anderson Cancer Center, Dipartimento di Cardiologia, Houston.
- American Heart Association. Statistiche di malattie cardiache e ictus-2005 Update. Dallas, Texas: American Heart Association; 2005. Disponibile su: www.americanheart.org/downloadable/heart/1105390918119HDSStats2005Update.pdf. Ultimo accesso 20 agosto 2006.
- Koelling TM, Chen RS, Lubwama RN, et al. The expanding national burden of heart failure in the United States: the influence of heart failure in women. Am Heart J. 2004 Jan;147(1):74-78.
- Hunt SA, Abraham WT, Chin MH, et al. ACC/AHA 2005 Guideline Update for the Diagnosis and Management of Chronic Heart Failure in the Adult: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure): developed in collaboration with the American College of Chest Physicians and the International Society for Heart and Lung Transplantation: endorsed by the Heart Rhythm Society. Circolazione. 2005 Sep 20;112(12):e154-235.Epub 2005 Sep 13.
- Peacock WF IV, Emerman CL, Wynne J, per il ADHERE Scientific Advisory Committee and Investigators and the ADHERE Study Group. L’uso precoce della nesiritide nel dipartimento di emergenza è associato a un miglioramento dei risultati: un’analisi del registro ADHERE. Ann Emerg Med. 2004;44:S78.
- Stevenson LW. Terapia su misura per obiettivi emodinamici per l’insufficienza cardiaca avanzata. Eur J Heart Fail. 1999 Aug;1(3):251-257.
- Stevenson LW, Perloff JK. La limitata affidabilità dei segni fisici per la stima dell’emodinamica nell’insufficienza cardiaca cronica. JAMA. 1989;261:884-888.
- Nakagawa O, Ogawa Y, Itoh H, et al. Rapida attivazione trascrizionale e turnover precoce dell’mRNA del peptide natriuretico cerebrale nell’ipertrofia del cardiocita. Prove per il peptide natriuretico del cervello come un ormone cardiaco “di emergenza” contro il sovraccarico ventricolare. J Clin Invest. 1995 Sep;96(3):1280-1287.
- Maeda K, Tsutamoto T, Wada A, et al. Il peptide natriuretico cerebrale plasmatico come marcatore biochimico di alta pressione end-diastolica ventricolare sinistra in pazienti con disfunzione ventricolare sinistra sintomatica. Am Heart J. 1998;135(5 Pt 1):825-832.
- Burger AJ. Una revisione degli effetti renali e neuro-ormonali del peptide natriuretico di tipo B. Congest Heart Fail. 2005 Jan-Feb;11(1):30-38.
- McCullough PA, Nowak RM, McCord J, et al. B-type natriuretic peptide and clinical judgment in emergency diagnosis of heart failure: analysis from Breathing Not Properly (BNP) Multinational Study. Circolazione. 2002 Jul;106(4):416-422.
- Maisel AS, Krishnaswamy P, Nowak RM, et al. Rapid measurement of B-type natriuretic peptide in the emergency diagnosis of heart failure. N Engl J Med. 2002 Jul 18;347(3):161-167.
- Adams KF, Lindenfeld J, Arnold JMO, et al. Executive Summary: HFSA 2006 Comprehensive Heart Failure Practice Guideline. J Card Fail. 2006 Feb;12(1):10-38.
- Dec GW. Insufficienza cardiaca acuta scompensata: il ruolo sempre più ridotto della terapia inotropa. J Am Coll Cardiol. 2005 Jul;46(1):65-67.
- Abraham WT, Adams KF, Fonarow GC, et al. Mortalità intraospedaliera nei pazienti con insufficienza cardiaca acuta scompensata che richiedono farmaci vasoattivi per via endovenosa: un’analisi dal registro nazionale dell’insufficienza cardiaca acuta scompensata (ADHERE). J Am Coll Cardiol. 2005 Jul;46(1):57-64.
- Burger AJ, Horton DP, LeJemtel T, et al. Effect of nesiritide (B-type natriuretic peptide) and dobutamine on ventricular arrhythmias in the treatment of patients with acutely decompensated congestive heart failure: the PRECEDENT study. Am Heart J. 2002 Dec;144(6):1102-1108.
- Woo KS, Nicholls MG. Alta prevalenza di tosse persistente con gli inibitori dell’enzima di conversione dell’angiotensina nei cinesi. Br J Clin Pharmacol. 1995 Aug;40(2):141-144.
- Pfeffer MA, McMurray JJ, Velazquez EJ, et al. Valsartan, captopril, o entrambi in infarto miocardico complicato da insufficienza cardiaca, disfunzione ventricolare sinistra, o entrambi. N Engl J Med. 2003 Nov 13;349(20):1893-1906. Epub 2003 Nov 10.
- Granger CB, McMurray JJ, Yusuf S, et al. Effetti di candesartan in pazienti con insufficienza cardiaca cronica e ridotta funzione sistolica ventricolare sinistra intolleranti agli inibitori dell’enzima di conversione dell’angiotensina: il CHARM-Alternative trial. Lancet. 2003 Sep 6;362(9386):772-776.
- Pitt B, Zannad F, Remme WJ, et al. L’effetto dello spironolattone sulla morbilità e mortalità in pazienti con grave insufficienza cardiaca. Randomized Aldactone Evaluation Study Investigators. N Engl J Med. 1999 Sep 2;341(10):709-717.
- Albert NM, Eastwood CA, Edwards ML. Pratica basata sull’evidenza per l’insufficienza cardiaca acuta scompensata. Crit Care Nurse. 2004 Dec;24(6):14-16, 18-24, 26-29; quiz 30-31.