Risultati dell’apprendimento
- Identificare i tipi di recettori, la loro composizione molecolare e le differenze tra loro
I recettori sono molecole proteiche nella cellula bersaglio o sulla sua superficie che legano un ligando. Ci sono due tipi di recettori, recettori interni e recettori di superficie cellulare.
Recettori interni

Figura 1. Le molecole di segnalazione idrofobiche tipicamente si diffondono attraverso la membrana plasmatica e interagiscono con i recettori intracellulari nel citoplasma. Molti recettori intracellulari sono fattori di trascrizione che interagiscono con il DNA nel nucleo e regolano l’espressione genica.
I recettori interni, noti anche come recettori intracellulari o citoplasmatici, si trovano nel citoplasma della cellula e rispondono a molecole di ligandi idrofobici che sono in grado di viaggiare attraverso la membrana plasmatica. Una volta all’interno della cellula, molte di queste molecole si legano a proteine che agiscono come regolatori della sintesi di mRNA (trascrizione) per mediare l’espressione genica. L’espressione genica è il processo cellulare di trasformazione delle informazioni contenute nel DNA di una cellula in una sequenza di amminoacidi, che alla fine forma una proteina. Quando il ligando si lega al recettore interno, si innesca un cambiamento conformazionale che espone un sito di legame al DNA sulla proteina. Il complesso ligando-recettore si sposta nel nucleo, poi si lega a specifiche regioni regolatrici del DNA cromosomico e promuove l’inizio della trascrizione (Figura 1). La trascrizione è il processo di copiatura delle informazioni nel DNA di una cellula in una forma speciale di RNA chiamata RNA messaggero (mRNA); la cellula usa le informazioni nell’mRNA (che si sposta nel citoplasma e si associa ai ribosomi) per collegare specifici aminoacidi nell’ordine corretto, producendo una proteina. I recettori interni possono influenzare direttamente l’espressione genica senza dover passare il segnale ad altri recettori o messaggeri.
Ricettori di superficie cellulare
I recettori di superficie cellulare, noti anche come recettori transmembrana, sono proteine di superficie cellulare, ancorate alla membrana (integrali) che si legano a molecole di ligandi esterni. Questo tipo di recettore attraversa la membrana plasmatica ed esegue la trasduzione del segnale, in cui un segnale extracellulare viene convertito in un segnale intercellulare. I ligandi che interagiscono con i recettori di superficie cellulare non devono entrare nella cellula che influenzano. I recettori della superficie cellulare sono anche chiamati proteine o marcatori cellula-specifici perché sono specifici per i singoli tipi di cellule.
Ogni recettore della superficie cellulare ha tre componenti principali: un dominio legante esterno, una regione idrofoba che attraversa la membrana e un dominio intracellulare all’interno della cellula. Il dominio legante è chiamato anche dominio extracellulare. La dimensione e l’estensione di ciascuno di questi domini variano ampiamente, a seconda del tipo di recettore.
Perché le proteine recettoriali della superficie cellulare sono fondamentali per il normale funzionamento delle cellule, non dovrebbe sorprendere che un malfunzionamento in una di queste proteine possa avere gravi conseguenze. È stato dimostrato che gli errori nelle strutture proteiche di alcune molecole recettoriali hanno un ruolo nell’ipertensione (pressione alta), nell’asma, nelle malattie cardiache e nel cancro.
Come i virus riconoscono un ospite
A differenza delle cellule viventi, molti virus non hanno una membrana plasmatica o alcuna delle strutture necessarie per sostenere la vita. Alcuni virus sono semplicemente composti da un guscio proteico inerte contenente DNA o RNA. Per riprodursi, i virus devono invadere una cellula vivente, che funge da ospite, e poi prendere il controllo dell’apparato cellulare dell’ospite. Ma come fa un virus a riconoscere il suo ospite?
I virus spesso si legano ai recettori della superficie cellulare della cellula ospite. Per esempio, il virus che causa l’influenza umana si lega specificamente ai recettori sulle membrane delle cellule del sistema respiratorio. Le differenze chimiche nei recettori della superficie cellulare tra gli ospiti significano che un virus che infetta una specie specifica (per esempio l’uomo) non può infettare un’altra specie (per esempio i polli).
Tuttavia, i virus hanno quantità molto piccole di DNA o RNA rispetto all’uomo e, di conseguenza, la riproduzione virale può avvenire rapidamente. La riproduzione virale produce invariabilmente errori che possono portare a cambiamenti nei virus appena prodotti; questi cambiamenti significano che le proteine virali che interagiscono con i recettori della superficie cellulare possono evolvere in modo tale da potersi legare ai recettori di un nuovo ospite. Questi cambiamenti avvengono casualmente e abbastanza spesso nel ciclo riproduttivo di un virus, ma i cambiamenti hanno importanza solo se un virus con nuove proprietà di legame entra in contatto con un ospite adatto. Nel caso dell’influenza, questa situazione può verificarsi in ambienti in cui animali e persone sono a stretto contatto, come gli allevamenti di pollame e suini. Una volta che un virus salta a un nuovo ospite, può diffondersi rapidamente. Gli scienziati osservano da vicino i virus appena apparsi (chiamati virus emergenti) nella speranza che tale monitoraggio possa ridurre la probabilità di epidemie virali globali.
I recettori a superficie cellulare sono coinvolti nella maggior parte della segnalazione negli organismi multicellulari. Ci sono tre categorie generali di recettori di superficie cellulare: recettori legati ai canali ionici, recettori legati alle proteine G e recettori legati agli enzimi.

Figura 2. I canali ionici Gated formano un poro attraverso la membrana plasmatica che si apre quando la molecola di segnalazione si lega. Il poro aperto permette quindi agli ioni di entrare o uscire dalla cellula.
I recettori legati ai canali ionici legano un ligando e aprono un canale attraverso la membrana che permette il passaggio di ioni specifici. Per formare un canale, questo tipo di recettore a superficie cellulare ha un’ampia regione che attraversa la membrana. Per interagire con le code degli acidi grassi fosfolipidi che formano il centro della membrana plasmatica, molti degli aminoacidi nella regione che attraversa la membrana sono di natura idrofoba. Al contrario, gli amminoacidi che rivestono l’interno del canale sono idrofili per permettere il passaggio di acqua o di ioni. Quando un ligando si lega alla regione extracellulare del canale, c’è un cambiamento conformazionale nella struttura delle proteine che permette il passaggio di ioni come il sodio, il calcio, il magnesio e l’idrogeno (Figura 2).
I recettori legati alle proteine G legano un ligando e attivano una proteina di membrana chiamata proteina G. La proteina G attivata interagisce poi con un canale ionico o un enzima nella membrana (Figura 3). Tutti i recettori legati alla proteina G hanno sette domini transmembrana, ma ogni recettore ha il suo specifico dominio extracellulare e il suo sito di legame con la proteina G.
La segnalazione cellulare tramite i recettori legati alla proteina G avviene come una serie ciclica di eventi. Prima che il ligando si leghi, la proteina G inattiva può legarsi a un sito appena rivelato sul recettore specifico per il suo legame. Una volta che la proteina G si lega al recettore, il cambiamento di forma risultante attiva la proteina G, che rilascia GDP e raccoglie GTP. Le subunità della proteina G si dividono poi nella subunità α e nella subunità βγ. Uno o entrambi questi frammenti di proteina G possono essere in grado di attivare altre proteine come risultato. Dopo un po’, il GTP sulla subunità α attiva della proteina G viene idrolizzato in GDP e la subunità βγ viene disattivata. Le subunità si riassociano per formare la proteina G inattiva e il ciclo ricomincia.
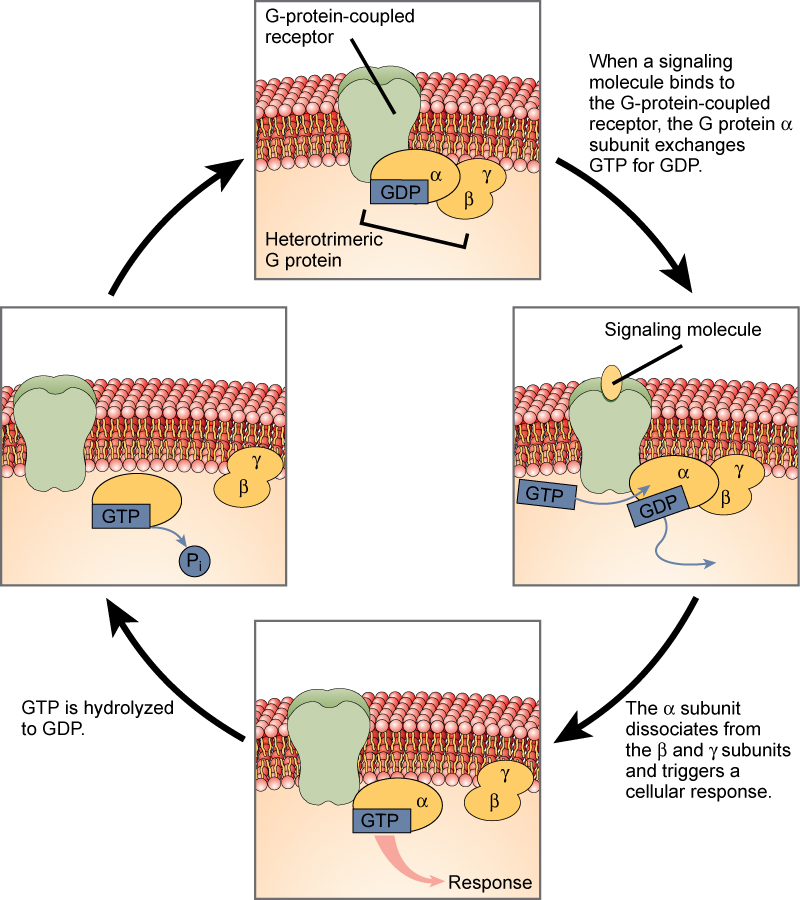
Figura 3. Le proteine G eterotrimeriche hanno tre subunità: α, β e γ. Quando una molecola di segnalazione si lega a un recettore accoppiato alla proteina G nella membrana plasmatica, una molecola di GDP associata alla subunità α viene scambiata con GTP. Le subunità β e γ si dissociano dalla subunità α, e una risposta cellulare è innescata o dalla subunità α o dalla coppia βγ dissociata. L’idrolisi del GTP in GDP termina il segnale.
I recettori legati alle proteine G sono stati ampiamente studiati e molto è stato appreso sui loro ruoli nel mantenimento della salute. I batteri che sono patogeni per l’uomo possono rilasciare veleni che interrompono la funzione specifica dei recettori legati alle proteine G, portando a malattie come la pertosse, il botulismo e il colera.

Figura 4. Trasmesso principalmente attraverso l’acqua potabile contaminata, il colera è una delle principali cause di morte nel mondo in via di sviluppo e nelle aree in cui i disastri naturali interrompono la disponibilità di acqua pulita. (credit: New York City Sanitary Commission)
Nel colera (Figura 4), per esempio, il batterio Vibrio cholerae, trasportato dall’acqua, produce una tossina, il coleragen, che si lega alle cellule che rivestono l’intestino tenue. La tossina entra poi in queste cellule intestinali, dove modifica una proteina G che controlla l’apertura di un canale del cloruro e lo fa rimanere continuamente attivo, causando grandi perdite di fluidi dal corpo e una disidratazione potenzialmente fatale come risultato.
I servizi igienici moderni eliminano la minaccia di epidemie di colera, come quella che ha travolto New York City nel 1866. Questo poster dell’epoca mostra come, all’epoca, il modo in cui la malattia veniva trasmessa non era compreso.
I recettori legati a un enzima sono recettori sulla superficie delle cellule con domini intracellulari che sono associati a un enzima. In alcuni casi, il dominio intracellulare del recettore stesso è un enzima. Altri recettori legati a un enzima hanno un piccolo dominio intracellulare che interagisce direttamente con un enzima. I recettori legati all’enzima hanno normalmente grandi domini extracellulari e intracellulari, ma la regione che attraversa la membrana consiste in una singola regione alfa-elica del filamento peptidico. Quando un ligando si lega al dominio extracellulare, un segnale viene trasferito attraverso la membrana, attivando l’enzima. L’attivazione dell’enzima mette in moto una catena di eventi all’interno della cellula che alla fine porta a una risposta. Un esempio di questo tipo di recettore legato all’enzima è il recettore tirosin-chinasico (Figura 5). Una chinasi è un enzima che trasferisce gruppi fosfato dall’ATP a un’altra proteina. Il recettore della tirosina chinasi trasferisce gruppi fosfato a molecole di tirosina (residui di tirosina). In primo luogo, le molecole di segnalazione si legano al dominio extracellulare di due recettori tirosin-chinasi vicini. I due recettori vicini si legano poi insieme, o dimerizzano. I fosfati vengono poi aggiunti ai residui di tirosina sul dominio intracellulare dei recettori (fosforilazione). I residui fosforilati possono quindi trasmettere il segnale al prossimo messaggero all’interno del citoplasma.
Domanda pratica

Figura 5. Un recettore tirosin-chinasi è un recettore legato a un enzima con una singola regione transmembrana e domini extracellulari e intracellulari. Il legame di una molecola di segnalazione al dominio extracellulare causa la dimerizzazione del recettore. I residui di tirosina sul dominio intracellulare sono poi autofosforilati, innescando una risposta cellulare a valle. Il segnale viene terminato da una fosfatasi che rimuove i fosfati dai residui di fosfotirosina.
HER2 è un recettore tirosin-chinasi. Nel 30% dei tumori al seno umani, HER2 è permanentemente attivato, con conseguente divisione cellulare sregolata. Lapatinib, un farmaco usato per trattare il cancro al seno, inibisce l’autofosforilazione della tirosin-chinasi del recettore HER2 (il processo con cui il recettore aggiunge fosfati su se stesso), riducendo così la crescita del tumore del 50%. Oltre all’autofosforilazione, quale delle seguenti fasi sarebbe inibita da Lapatinib?
- Il legame delle molecole di segnalazione, la dimerizzazione e la risposta cellulare a valle
- Dimerizzazione, e la risposta cellulare a valle
- La risposta cellulare a valle
- L’attività della fosfatasi, la dimerizzazione e la risposta cellulare a valle
Prova
Contribuisci!
Migliorare questa paginaPer saperne di più