Gli aminoglicosidi mostrano un’attività battericida dipendente dalla concentrazione contro “la maggior parte dei bacilli aerobi gram-negativi e anaerobi facoltativi” ma non contro gli anaerobi gram-negativi e la maggior parte dei batteri gram-positivi. Richiedono solo un breve tempo di contatto e sono più efficaci contro le popolazioni batteriche suscettibili che si moltiplicano rapidamente. Queste attività sono attribuite a una modalità primaria di azione come inibitori della sintesi proteica, anche se ulteriori meccanismi sono implicati per alcuni agenti specifici, e/o descrizioni meccanicistiche complete non sono ancora disponibili.
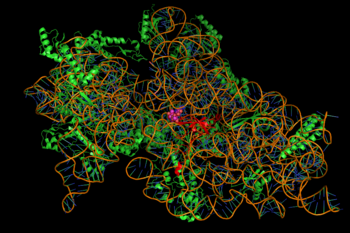
L’inibizione della sintesi proteica è mediata attraverso il legame energia-dipendente degli aminoglicosidi, talvolta irreversibile, al ribosoma batterico citosolico, associato alla membrana (immagine a destra). (Gli aminoglicosidi attraversano prima le pareti cellulari batteriche – l’allipopolisaccaride nei batteri gram-negativi – e le membrane cellulari, dove vengono attivamente trasportati). Mentre le fasi specifiche della sintesi proteica interessate possono variare un po’ tra gli agenti aminoglicosidici specifici, così come la loro affinità e il grado di legame, la presenza di aminoglicosidi nel citosol generalmente disturba l’allungamento del peptide alla subunità ribosomiale 30S, dando luogo a una traduzione imprecisa dell’mRNA e quindi alla biosintesi di proteine che sono troncate, o portano composizioni di aminoacidi alterate in punti particolari. In particolare, il legame compromette il proofreading traslazionale portando a una lettura errata del messaggio dell’RNA, a una terminazione prematura o a entrambe, e quindi all’imprecisione del prodotto proteico tradotto. Il sottoinsieme di proteine aberranti che vengono incorporate nella membrana cellulare batterica può quindi portare a cambiamenti nella sua permeabilità e quindi a “un’ulteriore stimolazione del trasporto di aminoglicosidi”. La porzione di aminozucchero di questa classe di molecole (per esempio, la 2-deossistreptamina nelle kanamicine, gentamicine e tobramicina, vedi sopra) sono implicate nell’associazione della piccola molecola con le strutture ribosomiali che portano alle infedeltà nella traduzione (ibid.). È stata anche suggerita l’inibizione della traslocazione ribosomiale, cioè il movimento del peptidil-tRNA dal sito A al sito P. Recenti esperimenti di tracciamento a singola molecola in E. coli vivo hanno mostrato una sintesi proteica in corso ma più lenta dopo il trattamento con diversi farmaci aminoglicosidi. (La spectinomicina, una classe di struttura chimica correlata ma distinta, spesso discussa con gli aminoglicosidi, non induce la lettura errata dell’mRNA e generalmente non è battericida.)
Infine, un ulteriore “effetto cellula-membrana” si verifica anche con gli aminoglicosidi; “l’integrità funzionale della membrana cellulare batterica” può essere persa, più tardi nei corsi temporali di esposizione e trasporto degli aminoglicosidi.
Farmacocinetica e farmacodinamicaModifica
C’è una significativa variabilità nel rapporto tra la dose somministrata e il livello plasmatico risultante nel sangue. Il monitoraggio terapeutico dei farmaci (TDM) è necessario per ottenere la dose corretta. Questi agenti mostrano un effetto post-antibiotico in cui non c’è nessun livello di farmaco o molto poco rilevabile nel sangue, ma sembra esserci ancora inibizione della ricrescita batterica. Questo è dovuto al legame forte e irreversibile al ribosoma, e rimane intracellulare molto tempo dopo che i livelli plasmatici scendono, e permette un intervallo di dosaggio prolungato. A seconda della loro concentrazione, agiscono come agenti batteriostatici o battericidi.
IndicazioniModifica
Gli aminoglicosidi sono utili soprattutto nelle infezioni che coinvolgono aerobi, batteri Gram-negativi, come Pseudomonas, Acinetobacter ed Enterobacter. Inoltre, alcuni micobatteri, compresi i batteri che causano la tubercolosi, sono suscettibili agli aminoglicosidi. La streptomicina è stato il primo farmaco efficace nel trattamento della tubercolosi, anche se il ruolo degli aminoglicosidi come la streptomicina e l’amikacina è stato eclissato (a causa della loro tossicità e della scomoda via di somministrazione) tranne che per i ceppi resistenti a più farmaci. L’uso più frequente degli aminoglicosidi è la terapia empirica per le infezioni gravi come la sepsi, le infezioni intra-addominali complicate, le infezioni complicate del tratto urinario e le infezioni nosocomiali del tratto respiratorio. Di solito, una volta che le colture dell’organismo causale sono coltivate e la loro suscettibilità testata, gli aminoglicosidi sono interrotti in favore di antibiotici meno tossici.
Come notato, gli aminoglicosidi sono per lo più inefficaci contro i batteri anaerobi, funghi e virus. Le infezioni causate da batteri Gram-positivi possono anche essere trattate con aminoglicosidi, ma altri tipi di antibiotici sono più potenti e meno dannosi per l’ospite. In passato, gli aminoglicosidi sono stati usati insieme agli antibiotici beta-lattamici nelle infezioni da streptococco per i loro effetti sinergici, in particolare nelle endocarditi. Una delle combinazioni più frequenti è l’ampicillina (un beta-lattamico, o antibiotico legato alla penicillina) e la gentamicina. Spesso, il personale ospedaliero si riferisce a questa combinazione come “amp e gent” o più recentemente chiamata “pen e gent” per penicillina e gentamicina.
Soppressione nonsenseModifica
L’interferenza con il proofreading dell’mRNA è stata sfruttata per trattare malattie genetiche che risultano da codoni di stop prematuri (che portano alla terminazione anticipata della sintesi proteica e proteine tronche). Gli aminoglicosidi possono indurre la cellula a superare i codoni di stop, inserire un aminoacido casuale ed esprimere una proteina completa. L’aminoglicoside gentamicina è stato usato per trattare le cellule della fibrosi cistica (CF) in laboratorio per indurle a produrre proteine di lunghezza completa. La FC è causata da una mutazione nel gene che codifica per la proteina CFTR (cystic fibrosis transmembrane conductance regulator). In circa il 10% dei casi di FC, la mutazione in questo gene causa la sua terminazione precoce durante la traduzione, portando alla formazione di una proteina CFTR tronca e non funzionale. Si ritiene che la gentamicina distorca la struttura del complesso ribosoma-RNA, portando a una lettura errata del codone di terminazione, inducendo il ribosoma a “saltare” la sequenza di stop e a continuare con il normale allungamento e la produzione della proteina CFTR.