Conduttività
Un’altra proprietà caratteristica dei composti ionici è la loro conduttività elettrica. La figura qui sotto mostra tre esperimenti in cui due elettrodi collegati ad una lampadina sono posti in becher contenenti tre diverse sostanze.
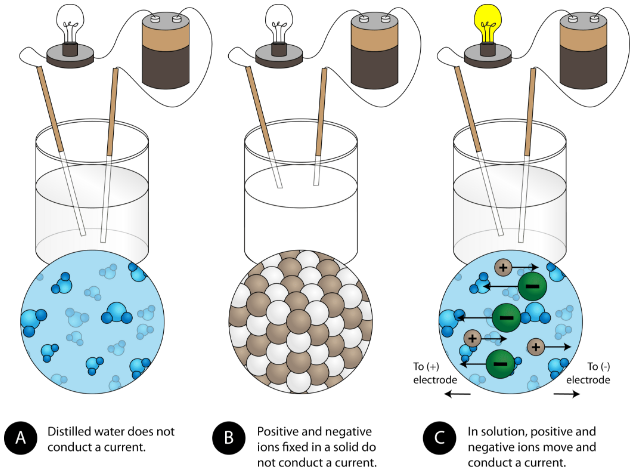
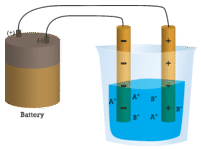
Nel primo becher, l’acqua distillata non conduce la corrente perché l’acqua è un composto molecolare. Nel secondo becher, anche il cloruro di sodio solido non conduce la corrente. Nonostante sia ionico e quindi composto da particelle cariche, il reticolo cristallino solido non permette agli ioni di muoversi tra gli elettrodi. Le particelle cariche mobili sono necessarie perché il circuito sia completo e la lampadina si accenda. Nel terzo bicchiere, il NaCl è stato sciolto nell’acqua distillata. Ora il reticolo cristallino è stato rotto e i singoli ioni positivi e negativi possono muoversi. I cationi si muovono verso un elettrodo, mentre gli anioni si muovono verso l’altro, permettendo all’elettricità di fluire (vedi figura sotto). La fusione di un composto ionico libera anche gli ioni per condurre una corrente. I composti ionici conducono una corrente elettrica quando vengono sciolti in acqua. La dissoluzione dei composti ionici in acqua sarà discussa nella sezione 9.3.
Esempio \(\PageIndex{1})
Scrivi l’equazione di dissociazione di NaCl solido in acqua.
Soluzione
NaCl(s) → Na+(aq) + Cl-(aq)
Esercizio \(\PageIndex{1})
Scrivi l’equazione di dissociazione di NH4NO3 solido in acqua.
Risposta
NH4NO3(s) → NH4+(aq) + NO3-(aq)