Akute dekompensierte Herzinsuffizienz (ADHF) ist nach wie vor einer der häufigsten Gründe für eine Krankenhauseinweisung. ADHF-Patienten, die komorbide Erkrankungen haben, stellen Hospitalisten vor hartnäckige Herausforderungen. Und ADHF wird häufig bei Patienten beobachtet, die 65 Jahre und älter sind. Die neurohormonelle Aktivierung, die als Folge der myokardialen Dysfunktion auftritt, führt zu einer fortschreitenden kardialen Verschlechterung und hämodynamischen Störungen, die sich schließlich als akute dekompensierte Herzinsuffizienz manifestieren.
Ziele des ADHF-Managements sind die Stabilisierung des Patienten, das Management der akuten hämodynamischen Anomalien, die Umkehrung der Symptome der durch Flüssigkeitsüberlastung verursachten Dyspnoe und die Einleitung evidenzbasierter Therapien, um das Fortschreiten der Krankheit zu verringern und das Überleben zu verbessern.
In diesem Artikel stellen wir den Fall einer 26-jährigen Frau mit ADHF vor und zeigen die Managementstrategien auf, die zu einer Stabilisierung und einem verbesserten Langzeitergebnis führen können.
 Klicken Sie für eine große Version
Klicken Sie für eine große Version
Abbildung 1. RA = rechtsatrialer Druck, PCWP = pulmonaler kapillarer Keildruck
Einleitung
Trotz großer Fortschritte in der Behandlung von Herzerkrankungen bleibt die Herzinsuffizienz ein wachsendes öffentliches Gesundheitsproblem epidemischen Ausmaßes in den Vereinigten Staaten. Etwa fünf Millionen Amerikaner haben eine Herzinsuffizienz, und bei mehr als 550.000 Patienten wird die Krankheit jedes Jahr diagnostiziert.1 Die jährliche Zahl der Krankenhauseinweisungen wegen Herzinsuffizienz als Hauptdiagnose ist von etwa 810.000 im Jahr 1990 auf mehr als 1 Million im Jahr 1999 gestiegen, und sie ist die häufigste Gruppe von Entlassungsdiagnosen bei Patienten über 65 Jahren.2 Medicare gab mehr Geld für die Diagnose und Behandlung von Herzinsuffizienz aus als für jede andere Diagnose – mehr als 27,9 Milliarden US-Dollar im Jahr 2005.1
Patienten, die mit ADHF in die Notaufnahme kommen, sind oft hämodynamisch instabil und zeigen schwere Symptome wie Dyspnoe und Flüssigkeitsüberladung. Eine schnelle Beurteilung und die sofortige Einleitung geeigneter Maßnahmen sind notwendig, um eine klinische Stabilität zu erreichen und einen längeren Krankenhausaufenthalt zu vermeiden, falls ein Krankenhausaufenthalt erforderlich ist. Die Sterblichkeitsrate bei ADHF im Krankenhaus liegt bei 5-8 %, die mediane Dauer des Krankenhausaufenthalts beträgt fünf Tage, und die Rehospitalisierungsrate nach sechs Monaten liegt bei etwa 50 %.1,3 Daher ist es klar, dass eine verbesserte Erkennung und Behandlung von größter Bedeutung sind. Mit diesen Zielen vor Augen stellen wir einen aktuellen Fall vor, der viele der Bedenken und Behandlungsmöglichkeiten für ADHF aufzeigt.
 Klicken Sie für große Version
Klicken Sie für große Version
Abbildung 1. RA = rechtsatriale Drücke, PCWP = pulmonaler kapillarer Keildruck
Falldarstellung
Karen A. ist eine 26-jährige Schwarze mit Morbus Hodgkin im Stadium III, diagnostiziert im Jahr 2000. Sie erhielt eine Chemotherapie (Cisplatin, Cytarabin, Doxorubicin, Rituxan, Gemcitabin) und entwickelte daraufhin im Jahr 2001 eine Chemotherapie-induzierte Kardiomyopathie mit einer Ejektionsfraktion von <20 %. Ihr Zustand stabilisierte sich, und sie blieb bis September 2002 in klinischer Remission.
Im Jahr 2003 erhielt sie eine autologe Stammzelltransplantation und stellte sich anschließend in der Notaufnahme mit Beschwerden über Müdigkeit, zunehmende Kurzatmigkeit in den letzten sieben Tagen und Ödeme der unteren Extremitäten vor. Sie berichtete auch über rechtsseitige pleuritische Brustschmerzen, verneinte aber damit verbundene Übelkeit, Erbrechen oder Diaphorese. In den drei Tagen vor der Aufnahme hatte sie 10 Pfund zugenommen. In den vergangenen sechs Monaten war sie bereits mehrfach wegen ADHF aufgenommen worden.
Die körperliche Untersuchung ergab eine wache, übergewichtige Frau mit mäßiger Atemnot und trockenen Schleimhäuten. Ihre Vitalzeichen zeigten eine Temperatur von 36,5° C, eine Herzfrequenz von 110 Schlägen pro Minute, eine Atemfrequenz von 20 Atemzügen pro Minute, einen Blutdruck von 111/73 mm Hg und eine Sauerstoffsättigung von 92 %. Sie hatte keinen skleralen Ikterus, aber eine juguläre Venendistention bis zum Winkel des Unterkiefers bei 45° aufrechter Position. Die kardiologische Untersuchung zeigte eine Tachykardie mit entfernten Herztönen und einem hörbaren dritten Herzton (S3) sowie ein systolisches Auswurfgeräusch des Grades 2/6 am linken Sternumrand. Die Lungenuntersuchung zeigte diffuse Knistergeräusche in beiden Lungenfeldern, aber keine Keuchgeräusche. Bei der Untersuchung des Abdomens war die rechte hypogastrische Region druckempfindlich und die Hepatomegalie auffällig. Die Haut war warm und trocken, ohne Zyanose, und die Extremitäten zeigten ein signifikantes beidseitiges Lochödem vor dem Schienbein bis zu den Knien.
 Klicken Sie für große Version
Klicken Sie für große Version
Abbildung 1. RA = rechtsatrialer Druck, PCWP = pulmonaler kapillarer Keildruck
Ihre aktuelle Medikation umfasste:
- Furosemid, 60 mg durch den Mund zweimal täglich;
- Carvedilol, 12.5 mg durch den Mund am Morgen, 6,25 mg am Abend;
- Amiodaron, 200 mg durch den Mund täglich; und
- Digoxin, 0,125 mg durch den Mund täglich.
Laborbefunde beinhalteten normale Elektrolyte, Blut-Harnstoff-Stickstoff und Serumkreatinin. Ihr Hämoglobin lag bei 11,3 g/l, und ihr B-Typ natriuretisches Peptid (BNP) lag bei 4.837 pg/ml. Die anfänglichen Herzenzyme waren negativ (Troponin I von <0. 03).
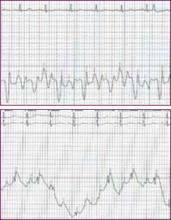
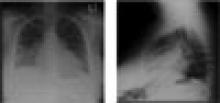
Das Röntgenbild des Brustkorbs zeigte eine mäßige Vergrößerung des Herzens mit beidseitiger Verdickung der subpleuralen Septumlinien und Unschärfe der Lungengefäße, die mit einem sich entwickelnden kardiogenen Lungenödem vereinbar war. Ein 12-Kanal-Elektrokardiogramm zeigte eine Sinustachykardie mit einer Frequenz von 110 Schlägen pro Minute und unspezifische ST-T-Wellenveränderungen in den inferioren Ableitungen, aber es wurden keine Q-Wellen festgestellt. Die Echokardiographie zeigte eine stark eingeschränkte linksventrikuläre systolische Funktion mit schwerer globaler Hypokinese des linken Ventrikels und einer gemessenen Auswurffraktion von 25-30 %. Es lag kein Perikarderguss vor.
Sie wurde mit der Diagnose ADHF auf der Telemetrie-Etage aufgenommen. Sie erhielt zusätzlichen Sauerstoff und eine Reihe von Herzenzymen, und ihr Elektrokardiogramm blieb negativ für Verletzungen oder Ischämie. Es wurde intravenöses Furosemid mit 40 mg alle 12 Stunden verabreicht. Nach 24 Stunden erhielt sie einen Bolus von Nesiritid (2 mcg/kg), gefolgt von einer kontinuierlichen Infusion mit 0,01 mcg/kg/min. Die kardiale Medikation wurde fortgesetzt und die Dosierung von Carvedilol auf 6,25 mg oral zweimal täglich reduziert.
Nach einer Phase der Diurese blieb die Patientin hochsymptomatisch; daher wurde eine Rechtsherzkatheteruntersuchung durchgeführt. Die Hämodynamik zeigte ein Herzzeitvolumen von drei Litern pro Minute, einen rechtsatrialen Druck von 20 mm Hg, einen rechtsventrikulären Druck von 70/20 mm Hg, einen pulmonalen Arteriendruck von 66/20 mm Hg mit einem mittleren Druck von 52 mm Hg und einen pulmonalen kapillaren Keildruck von 25 mm Hg. (Siehe Abbildungen 1 und 2, S. 23).
In den nächsten 24 Stunden hatte der Patient eine Urinausscheidung von mehr als drei Litern und war deutlich verbessert. Die Nesiritid-Infusion wurde nach 48 Stunden abgesetzt, und der Patient wurde vom zusätzlichen Sauerstoff entwöhnt. Lisinopril wurde mit 2,5 mg täglich oral verabreicht. Am vierten Krankenhaustag konnte die Patientin auf der Schwesternstation ohne zusätzlichen Sauerstoff gehen, und sie wurde wieder auf die vorherige Furosemid-Dosis von 60 mg zweimal täglich eingestellt.
Die Patientin wurde in das Heart Success Program (HSP) aufgenommen, ein interdisziplinäres Programm, das in der Einrichtung für Krebspatienten mit Herzinsuffizienz angeboten wird. Sie erhielt Patientenschulungsmaterial, das Schulungsvideos zum Management der Herzinsuffizienz, zur täglichen Gewichtskontrolle, zu Ernährung, Medikamenten, Bewegung und zu den emotionalen Aspekten der Herzinsuffizienz enthielt. Krankenschwestern mit einer Ausbildung in Herzinsuffizienz standen zur Verfügung, um Fragen der Patientin zu beantworten und weitere Anweisungen für die Nachsorge nach der Entlassung der Patientin zu geben. Der Patientin ging es soweit besser, dass sie in eine New York Heart Association (NYHA) Klasse II eingestuft werden konnte und nach fünf Tagen entlassen wurde, mit einem Nachsorgetermin in der Ambulanz eine Woche nach der Entlassung aus dem Krankenhaus.
Diskussion
Dieser Fall veranschaulicht die Herausforderungen bei der Diagnose und Behandlung von ADHF bei einem Krebspatienten mit bekannter Herzinsuffizienz in der Vorgeschichte. Eine rasche Beurteilung ist entscheidend, um eine Diagnose zu stellen und eine geeignete Intervention einzuleiten. Die Ziele der ADHF-Behandlung bleiben unabhängig von der Ätiologie die gleichen. Dazu gehören die Stabilisierung des Patienten, das Management akuter hämodynamischer Anomalien, die Umkehrung der Symptome der durch Flüssigkeitsüberlastung verursachten Dyspnoe und die Einleitung evidenzbasierter Therapien, um das Fortschreiten der Krankheit zu verringern und das Überleben zu verbessern. Die gleichen Prinzipien gelten auch, wenn der Patient eine schwere Komorbidität wie z. B. Krebs hat, und der Verdacht auf die Diagnose muss hoch bleiben.
Erstuntersuchung
Eine frühzeitige Diagnose und ein effektives Management von ADHF sind von entscheidender Bedeutung, da dies nachweislich die Zahl der Krankenhausaufenthalte und der Aufnahmen auf die Intensivstation reduziert, die Aufenthaltsdauer verkürzt und die Kosten des Krankenhausaufenthalts senkt.4 Eine umfassende Anamnese und körperliche Untersuchung muss durchgeführt werden, um Anzeichen und Symptome zu identifizieren, die zur Diagnose einer Herzinsuffizienz führen.
Wir müssen potenzielle Risikofaktoren wie Bluthochdruck, Dyslipidämie, Diabetes mellitus, koronare Herzkrankheit, Herzklappenerkrankungen, periphere Gefäßerkrankungen, Kardiomyopathie in der Familienanamnese, Rauchen, Alkoholkonsum, Schilddrüsenprobleme, Schlafapnoe und Infektionen in der jüngeren Vergangenheit (insbesondere Infektionen der oberen Atemwege, die eine virale Kardiomyopathie verursachen können) auswerten.
Als Teil der weiteren Untersuchung bei Krebspatienten sollte die mögliche frühere Exposition des Patienten gegenüber kardiotoxischen Substanzen (z.B., Anthrazykline, Trastuzumab, hochdosiertes Cyclophosphamid) oder eine mediastinale Bestrahlung. Chemotherapie-induzierte Kardiomyopathie wird zunehmend zu einem Problem bei der Behandlung von Herzinsuffizienz, da immer mehr Langzeit-Krebsüberlebende mit anthrazyklinhaltigen Chemotherapien oder anderen aggressiven Therapien behandelt werden.
Fokussieren Sie bei der körperlichen Untersuchung eines jeden Patienten auf Volumen und Perfusionsstatus. Die meisten Patienten, die mit einer akuten Dekompensation in die Notaufnahme kommen, sind volumenüberlastet. Die Volumenüberlastung äußert sich durch Symptome wie Dyspnoe, Orthopnoe und paroxysmale nächtliche Dyspnoe sowie Jugularvenendistention, hepatojugulären Reflux, Aszites, Ödeme und Risse in der Lunge.5 Crackles sind bei Patienten mit chronischer Herzinsuffizienz jedoch nicht immer vorhanden, da durch den verstärkten Lymphabfluss ständig Flüssigkeit in das Interstitium fließt und die Alveolen relativ trocken bleiben.6
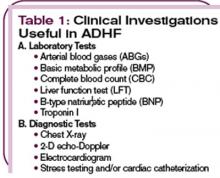
Zusätzlich zu einer umfassenden Anamnese und körperlichen Untersuchung helfen verschiedene Tests bei der Diagnosestellung. (Siehe Tabelle 1, oben links.) Eine Messung des natriuretischen Peptids vom B-Typ (BNP) erleichtert die Diagnose von ADHF. BNP ist ein endogen erzeugtes natriuretisches Peptid, das als Reaktion auf eine atriale oder ventrikuläre Expansion aufgrund von Volumenüberlastung und erhöhter Wandspannung aktiviert wird.7,8 Die zirkulierenden Spiegel von endogenem BNP sind bei ADHF-Patienten signifikant erhöht und stellen ein wertvolles Hilfsmittel für die Diagnose von Herzinsuffizienz in der Notaufnahme dar.9-11 Bei Karen A. betrug der BNP-Spiegel 4.837 pg/ml, was auf eine Herzinsuffizienz im Stadium D hinweist. Diese Diagnose wurde durch den Röntgenbefund eines kardiogenen Lungenödems bei schwerer linksventrikulärer Hypokinese und einer Auswurffraktion von 25-30 % bestätigt.
Obwohl Anamnese und körperliche Untersuchung wichtige Hinweise auf die zugrundeliegende kardiale Anomalie liefern können, sind sowohl invasive als auch nicht-invasive Tests notwendig, um eine definitive Diagnose der Herzinsuffizienz zu stellen und um potenziell verschlimmernde Bedingungen zu bewerten. Ein zweidimensionales Echokardiogramm mit Doppler-Flussuntersuchung ist ein wesentlicher diagnostischer Test zur Beurteilung der myokardialen Kontraktilität oder der Ejektionsfraktion. Das Echokardiogramm kann auch andere strukturelle Komponenten wie das Perikard, den Klappenstatus und hämodynamische Parameter beurteilen, die zur Entwicklung von ADHF beitragen können. Bei Patienten mit kardialen Risikofaktoren kann ein Myokard-Perfusionsbelastungstest oder eine Katheteruntersuchung das Vorhandensein einer koronaren Herzkrankheit als Mitverursacher identifizieren.
Ein 12-Kanal-Elektrokardiogramm ist notwendig, um den Rhythmus zu bestimmen und Hinweise auf einen akuten oder früheren Myokardinfarkt, eine Perikarditis, Erregungsleitungsanomalien oder eine linksventrikuläre Hypertrophie als Folge eines lang anhaltenden unkontrollierten Bluthochdrucks zu finden. Es ist bekannt, dass Rhythmusstörungen wie Vorhofflimmern ein auslösender Faktor für ADHF sein können.
Ein Röntgenbild des Brustkorbs ist erforderlich, um bei Flüssigkeitsüberladung ein Lungenödem aufzudecken und bei dilatativer Kardiomyopathie eine vergrößerte Herzsilhouette zu zeigen. Die Identifizierung der definitiven Ursache(n), die das Auftreten von ADHF auslösen, ist entscheidend für die Erstellung eines Managementplans und die Einleitung einer geeigneten Intervention. (Siehe Tabelle 2, S. 22.)
 Klicken Sie für große Version
Klicken Sie für große Version
Abbildung 1. RA = rechtsatriale Drücke, PCWP = pulmonaler kapillarer Keildruck
Sofortige Behandlung des ADHF
Es gibt neu entwickelte klinische Praxisrichtlinien für die Behandlung des ADHF, aber die Behandlung basiert immer noch weitgehend auf empirischer Evidenz.12 Beginnen Sie die ADHF-Behandlung in der Notaufnahme mit intravenösen Diuretika (sofern nicht kontraindiziert). Die Mehrheit der ADHF-Patienten spricht auf Diuretika allein an.13 Wenn der Patient schlecht auf Diuretika anspricht, hat sich die Verwendung von Nesiritid in Verbindung mit Diuretika als vorteilhaft erwiesen, wie die Analyse von Daten aus dem ADHERE-Register zeigt, die darauf hinweist, dass Patienten, die mit intravenösem Nesiritid behandelt wurden, eine niedrigere Krankenhausmortalität aufwiesen als Patienten, die mit Milrinon oder Dobutamin behandelt wurden.14 Weitere Optionen sind die Ultrafiltration, ein Eingriff, der die Aufenthaltsdauer und die Rehospitalisierungsrate bei Patienten mit ADHF reduziert.
Nesiritid ist eine rekombinante Form von BNP ohne direkte inotrope Wirkung, aber mit venösen, arteriellen und koronaren gefäßerweiternden Eigenschaften, die die Symptome bei ADHF verbessern können.15 Die empfohlene Dosierung für Nesiritid ist ein IV-Bolus von 2 mcg pro kg, gefolgt von einer kontinuierlichen Infusion von 0,01 mcg/kg/min. Bei einer Hypotonie mit einem systolischen Blutdruck von weniger als 100 mm Hg wird jedoch keine initiale IV-Bolusdosis empfohlen; stattdessen kann der Patient mit einer kontinuierlichen Infusion von 0,01 mcg/kg/min beginnen oder andere Therapien in Betracht ziehen.
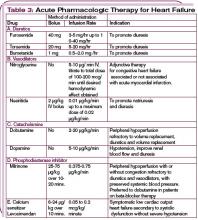
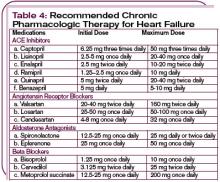
Bei hämodynamisch instabilen Patienten mit einem systolischen Blutdruck von weniger als 90 mm Hg oder bei Anzeichen einer Endorganhypoperfusion (kardiogener Schock) kann eine inotrope Unterstützung in Betracht gezogen werden, bis der Patient stabilisiert ist. (Siehe Tabelle 3, S. 22.) Beachten Sie, dass inotrope Mittel negative Auswirkungen auf das neurohormonale System haben und nicht routinemäßig empfohlen werden, aber zur vorübergehenden Stabilisierung unerlässlich sein können. (Weitere Informationen zur pharmakologischen Behandlung von ADHF siehe Tabelle 4, S. 24.)
 Klicken Sie für große Version
Klicken Sie für große Version
Abbildung 2. Posteroanteriores und laterales Thoraxröntgen mit basilären Infiltraten und vergrößerter Herzsilhouette
Subakutes Management von ADHF
Wenn die akute Dekompensation aufgehoben und ein euvolemischer Zustand erreicht ist, sollte die Therapie auf eine Kombination von drei Medikamentenklassen umgestellt werden: Diuretika, Angiotensin-Converting-Enzyme (ACE)-Hemmer und Betablocker, sofern nicht kontraindiziert. Der Nutzen dieser Medikamente ist durch zahlreiche groß angelegte klinische Studien belegt.3,12
Beginnen Sie bei allen Patienten mit Herzinsuffizienz aufgrund einer linksventrikulären systolischen Dysfunktion mit ACE-Hemmern (es sei denn, dies ist kontraindiziert oder der Patient verträgt sie nicht).3 Geben Sie Patienten, die kürzlich eine ADHF-Episode erlebt haben, ACE-I zusammen mit Diuretika, um den Natriumhaushalt aufrechtzuerhalten und um periphere und pulmonale Ödeme zu verhindern. ACE-Hemmer sind kontraindiziert für schwangere Patientinnen und Patientinnen im gebärfähigen Alter sowie für Personen, bei denen in der Vorgeschichte ein Angioödem oder Nierenversagen nach der Behandlung mit dem Medikament aufgetreten ist. Weisen Sie die Patienten an, plötzliche Lageveränderungen zu vermeiden, da es während der Einnahme von ACE-Hemmern zu orthostatischer Hypotonie kommen kann.
Einige Patienten vertragen ACE-Hemmer nicht, weil sie einen anhaltenden Husten haben, der bei ca. 5 % bis 10 % der kaukasischen Patienten und bei bis zu 50 % der chinesischen Patienten auftritt.16 Angiotensin-Rezeptor-Blocker (ARBs) sind eine etablierte Alternative.17 Zwei ARBs (Candesartan und Valsartan) werden für die Behandlung der Herzinsuffizienz empfohlen, basierend auf der Evidenz aus kontrollierten klinischen Studien.17,18 Diese Medikamente haben eine Reduktion der Krankenhausaufenthalte gezeigt, und Candesartan, wenn es als Alternative zu ACE-I eingesetzt wird, reduziert nachweislich die Mortalität. Außerdem zeigte sich bei Patienten mit nachgewiesener linksventrikulärer Dysfunktion nach Myokardinfarkt ein Nutzen von Valsartan, der dem von ACE-Hemmern nicht unterlegen war.17
Betablocker werden mit sehr niedrigen Dosen begonnen und bei Verträglichkeit schrittweise erhöht. Überwachen Sie die Patienten genau auf Symptome wie Hypotonie, signifikante Gewichtszunahme, Flüssigkeitsretention, Bradykardie und Herzblock. Informieren Sie die Patienten außerdem darüber, dass sie zu Beginn der Einnahme von Betablockern möglicherweise unter allgemeiner Müdigkeit oder Schwäche leiden. Bei einem Krebspatienten ist es schwierig, zwischen der durch die Krankheit verursachten Müdigkeit und den Nebenwirkungen der Therapie zu unterscheiden. Die mit der Betablocker-Therapie verbundene Müdigkeit verschwindet in der Regel spontan innerhalb weniger Tage. Bemühen Sie sich, die optimale Ziel-Beta-Blocker-Dosis zu erreichen.
Ein Aldosteron-Antagonist, wie Spironolacton oder Eplerenon, der in einer täglichen Dosis von 12,5 bis 25 mg zusätzlich zur Standardtherapie gegeben wird, blockiert effektiv die Wirkung von Aldosteron (RALES-Studie), um eine umfassende neurohormonelle Blockade zu erreichen.19 Bei der Verschreibung eines Aldosteronantagonisten, insbesondere in Kombination mit ACE-Hemmern und Schleifendiuretika, ist es wichtig, den Serumkaliumspiegel zu überwachen, da diese Kombination zu einer Hyperkaliämie führen kann.
 Für große Version anklicken
Für große Version anklickenDisease-Management-Programme
Ein umfassendes Management der Herzinsuffizienz beschränkt sich nicht nur auf die stationäre Versorgung während einer Episode von ADHF. Um wiederholte Krankenhausaufenthalte zu vermeiden, sollten zusätzliche Maßnahmen durch formale Disease-Management-Programme umgesetzt werden. Diese Disease-Management-Programme werden häufig von Krankenschwestern und -pflegern geleitet oder koordiniert, die sich mit der umfassenden Versorgung von Herzinsuffizienz-Patienten befassen und dabei den Schwerpunkt auf die Aufklärung und Beratung der Patienten legen, um deren Compliance zu verbessern.20
Die nicht-pharmakologischen Behandlungsstrategien, die in Disease-Management-Programmen betont werden, haben sich als wirksam erwiesen, um positive Ergebnisse zu erzielen. Dazu gehört die Beratung der Patienten zum Ernährungsmanagement, einschließlich der Empfehlung einer Zwei-Gramm-Natrium-Diät, der Einschränkung von Alkohol und der adäquaten Ergänzung von Elektrolytverlusten durch Diuretika. Das Führen eines Tagebuchs über das tägliche Gewicht des Patienten zu Hause und das Mitbringen dieses Tagebuchs zu Arztbesuchen hilft sowohl dem Patienten als auch dem Arzt, die Flüssigkeitsretention effizient zu überwachen.
Hypotonie ist eine häufige Nebenwirkung der pharmakologischen Therapie der Herzinsuffizienz. Sorgen Sie für eine umfassende Aufklärung von Patient und Familie, um ein unnötiges Absetzen der Medikamente zu vermeiden. Ein systolischer Blutdruck von 90 mm Hg ist akzeptabel, solange keine begleitenden Symptome wie Schwindel oder Synkopen auftreten.
Ermutigen Sie zu Aktivitätsrichtlinien, einschließlich der Teilnahme an Bewegungsprogrammen. Die Teilnahme an Selbsthilfegruppentreffen bietet einen Ort, an dem Patienten gemeinsame Probleme und Sorgen mit anderen in ähnlicher Situation teilen können. Planen Sie ein bis zwei Wochen nach der Entlassung aus dem Krankenhaus eine ambulante Nachuntersuchung in einer Herzinsuffizienz-Klinik, in der die Herzinsuffizienz-Schulung verstärkt wird, um eine weitere ADHF-Einweisung zu verhindern.
Zusammenfassung
Trotz der zusätzlichen Herausforderungen beinhaltet die Behandlung von ADHF bei einem Patienten mit einer schweren Begleiterkrankung wie Krebs die gleichen Ziele wie die Behandlung von ADHF bei jedem anderen Patienten. Mit einer schnellen Beurteilung und angemessenen Intervention wird dem Patienten die bestmögliche Überlebenschance gegeben. TH
Die Autoren arbeiten am University of Texas M.D. Anderson Cancer Center, Department of Cardiology, Houston.
- American Heart Association. Heart Disease and Stroke Statistics-2005 Update. Dallas, Texas: American Heart Association; 2005. Verfügbar unter: www.americanheart.org/downloadable/heart/1105390918119HDSStats2005Update.pdf. Last accessed August 20, 2006.
- Koelling TM, Chen RS, Lubwama RN, et al. The expanding national burden of heart failure in the United States: the influence of heart failure in women. Am Heart J. 2004 Jan;147(1):74-78.
- Hunt SA, Abraham WT, Chin MH, et al. ACC/AHA 2005 Guideline Update for the Diagnosis and Management of Chronic Heart Failure in the Adult: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure): entwickelt in Zusammenarbeit mit dem American College of Chest Physicians und der International Society for Heart and Lung Transplantation: befürwortet von der Heart Rhythm Society. Circulation. 2005 Sep 20;112(12):e154-235.Epub 2005 Sep 13.
- Peacock WF IV, Emerman CL, Wynne J, for the ADHERE Scientific Advisory Committee and Investigators and the ADHERE Study Group. Der frühe Einsatz von Nesiritid in der Notaufnahme ist mit einem verbesserten Ergebnis assoziiert: eine ADHERE-Registeranalyse. Ann Emerg Med. 2004;44:S78.
- Stevenson LW. Maßgeschneiderte Therapie auf hämodynamische Ziele bei fortgeschrittener Herzinsuffizienz. Eur J Heart Fail. 1999 Aug;1(3):251-257.
- Stevenson LW, Perloff JK. Die begrenzte Zuverlässigkeit von körperlichen Zeichen zur Einschätzung der Hämodynamik bei chronischer Herzinsuffizienz. JAMA. 1989;261:884-888.
- Nakagawa O, Ogawa Y, Itoh H, et al. Rapid transcriptional activation and early mRNA turnover of brain natriuretic peptide in cardiocyte hypertrophy. Beweise für Hirnnatriuretisches Peptid als kardiales „Notfall“-Hormon gegen ventrikuläre Überlastung. J Clin Invest. 1995 Sep;96(3):1280-1287.
- Maeda K, Tsutamoto T, Wada A, et al. Plasma brain natriuretic peptide as a biochemical marker of high left ventricular end-diastolic pressure in patients with symptomatic left ventricular dysfunction. Am Heart J. 1998;135(5 Pt 1):825-832.
- Burger AJ. A review of the renal and neurohormonal effects of B-type natriuretic peptide. Congest Heart Fail. 2005 Jan-Feb;11(1):30-38.
- McCullough PA, Nowak RM, McCord J, et al. B-type natriuretic peptide and clinical judgment in emergency diagnosis of heart failure: analysis from Breathing Not Properly (BNP) Multinational Study. Circulation. 2002 Jul;106(4):416-422.
- Maisel AS, Krishnaswamy P, Nowak RM, et al. Rapid measurement of B-type natriuretic peptide in the emergency diagnosis of heart failure. N Engl J Med. 2002 Jul 18;347(3):161-167.
- Adams KF, Lindenfeld J, Arnold JMO, et al. Executive Summary: HFSA 2006 Comprehensive Heart Failure Practice Guideline. J Card Fail. 2006 Feb;12(1):10-38.
- Dec GW. Akute dekompensierte Herzinsuffizienz: die schwindende Rolle der inotropen Therapie. J Am Coll Cardiol. 2005 Jul;46(1):65-67.
- Abraham WT, Adams KF, Fonarow GC, et al. In-hospital mortality in patients with acute decompensated heart failure requiring intravenous vasoactive medications: an analysis from the Acute Decompensated Heart Failure National Registry (ADHERE). J Am Coll Cardiol. 2005 Jul;46(1):57-64.
- Burger AJ, Horton DP, LeJemtel T, et al. Effect of nesiritide (B-type natriuretic peptide) and dobutamine on ventricular arrhythmias in the treatment of patients with acutely decompensated congestive heart failure: the PRECEDENT study. Am Heart J. 2002 Dec;144(6):1102-1108.
- Woo KS, Nicholls MG. Hohe Prävalenz von persistierendem Husten unter Angiotensin-Converting-Enzyme-Hemmern in China. Br J Clin Pharmacol. 1995 Aug;40(2):141-144.
- Pfeffer MA, McMurray JJ, Velazquez EJ, et al. Valsartan, Captopril, or both in myocardial infarction complicated by heart failure, left ventricular dysfunction, or both. N Engl J Med. 2003 Nov 13;349(20):1893-1906. Epub 2003 Nov 10.
- Granger CB, McMurray JJ, Yusuf S, et al. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function intolerant to angiotensin-converting-enzyme inhibitors: the CHARM-Alternative trial. Lancet. 2003 Sep 6;362(9386):772-776.
- Pitt B, Zannad F, Remme WJ, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med. 1999 Sep 2;341(10):709-717.
- Albert NM, Eastwood CA, Edwards ML. Evidenzbasierte Praxis bei akuter dekompensierter Herzinsuffizienz. Crit Care Nurse. 2004 Dec;24(6):14-16, 18-24, 26-29; Abfrage 30-31.