Introduction
L’hémoptysie est un symptôme fréquent en pneumologie et nécessite une intervention rapide et minutieuse. Les causes d’hémorragie des voies respiratoires inférieures sont nombreuses. On pense toujours que la bronchectasie, la tuberculose, le carcinome bronchogénique et diverses infections pulmonaires sont les causes les plus fréquentes d’hémoptysie massive.1, 2 Une grande série récente démontre la prévalence des causes d’hémoptysie massive dans un hôpital universitaire.3 En outre, selon l’étude, chez 30 % des patients présentant une hémoptysie, aucune cause ne peut être identifiée même après une évaluation minutieuse, y compris une bronchoscopie. Ces patients sont classés comme ayant une hémoptysie cryptogénique ou idiopathique.4 Dans les cas où aucune comorbidité associée ne peut être exclue avec certitude, le sous-groupe des hémoptysies cryptogéniques partage des facteurs de risque communs avec les patients dont l’hémoptysie s’explique par une bronchite chronique dans un contexte d’antécédents de tabagisme5 , 6 L’hypervascularisation au sein de la paroi bronchique reste un processus mal défini dans la pathogenèse de l’inflammation chronique des voies respiratoires, ressemblant aux constatations endobronchiques décrites dans la maladie de Dieulafoy.
Nous présentons un cas d’hémoptysie massive due à une hypervascularisation et à une fistule bronchovasculaire ultérieure, liée à un antécédent de tabagisme.
Rapport de cas
Nous rapportons un cas remarquable de femme de 49 ans, femme au foyer, ayant des antécédents de tabagisme (29 paquets de cigarettes/an), sans autre exposition à des toxiques, présentant une toux et une expectoration sanguine abondante, non quantifiée, sans autre sémiologie.
Aux urgences, la patiente était stable hémodynamiquement. Elle a nécessité une oxygénothérapie complémentaire sans assistance ventilatoire mécanique non invasive ou invasive. Les études de laboratoire ont révélé une hémoglobine de 9,0 g/dL, sans thrombocytopénie ni coagulopathie. La bronchoscopie urgente a montré d’abondants restes de sang sur l’arbre trachéobronchique et des signes d’inflammation chronique sans saignement actif. Nous avons donc décidé de poursuivre l’évaluation diagnostique car le saignement avait cessé et le patient restait cliniquement stable.
Le patient n’avait pas de télangiectasies sur la peau ou les muqueuses, et il n’y avait pas d’antécédents familiaux d’hémoptysie, d’anévrismes cérébraux, d’épistaxis ou de saignements gastro-intestinaux, qui auraient pu suggérer une possible télangiectasie hémorragique héréditaire. Des tests de laboratoire supplémentaires ont permis d’écarter d’autres causes d’hémoptysie, allant d’un dysfonctionnement hépatique, de néoplasmes ou d’infections, à des troubles immunitaires ou inflammatoires. Les études radiologiques ont écarté les hyperlucidités régionales ou les bulles. De plus, la tomodensitométrie du thorax a permis d’écarter les anomalies difficiles à détecter par bronchoscopie, telles que les lésions de masse (par exemple, malformations artério-veineuses, cancer ou aspergillome), les bronchectasies, les abcès pulmonaires ou les anévrismes des artères pulmonaires. Un échocardiogramme a écarté une sténose mitrale, une hypertension pulmonaire, une endocardite ou une cardiopathie congénitale. L’exploration fonctionnelle pulmonaire a montré une bronchopneumopathie chronique obstructive (BPCO) modérée (grade GOLD 2).
Le septième jour, un nouvel épisode d’hémoptysie massive a eu lieu. A cette occasion, le patient était hémodynamiquement instable et les tests de laboratoire ont révélé une hémoglobine de 7,3 g/dL. Deux unités de globules rouges « emballés » et un volume suffisant de liquide cristalloïde ont été administrés. Le patient a refusé une autre bronchoscopie. Une artériographie bronchique urgente a été réalisée. Le cathétérisme sélectif du tronc intercostobronchique droit a montré des caractéristiques d’hypervascularisation marquée, notamment une artère bronchique droite tortueuse et dilatée et des shunts rétrogrades bronchiques-pulmonaires dans l’apex droit (Figure 1). Le cathétérisme sélectif de l’artère bronchique gauche a montré une fistule bronchovasculaire, où le contraste fuit du vaisseau sanguin dessinant la bronchographie de l’arbre bronchique gauche (Figure 2, panneau A), et une division supérieure de l’artère bronchique gauche tortueuse et dilatée également (Figure 2, panneau B). L’arrêt immédiat de l’hémoptysie a été obtenu après embolisation de la fistule bronchovasculaire et du tronc intercostobronchique droit avec des microsphères d’alcool polyvinylique de 700-900 μm jusqu’à la stase complète de l’artère. Après l’intervention, le patient a été stabilisé sur le plan hémodynamique et n’a pas présenté de nouveaux épisodes d’hémoptysie. Après le dernier épisode, la patiente a arrêté de fumer et elle est restée asymptomatique jusqu’à présent.
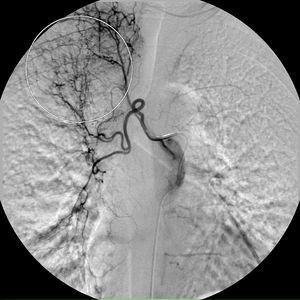
Figure 1. Cathétérisme sélectif du tronc intercostobronchique droit. Cercle : shunts rétrogrades broncho-pulmonaires dans l’apex droit.
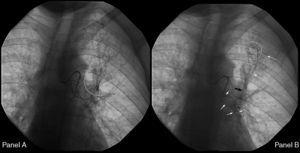
Figure 2. Artériographie de la bronche gauche. Panneau A. Cercle : fistule bronchovasculaire. Panneau B. Flèche noire : Formation d’une fistule entre un vaisseau et l’arbre trachéobronchique. Flèches blanches : fuite de contraste du vaisseau dessinant la bronchographie de l’arbre bronchique. Cercle : division supérieure tortueuse et dilatée de l’artère bronchique gauche.
Discussion
Nous avons présenté un cas d’hémoptysie massive due à une fistule bronchovasculaire chez un patient ayant des antécédents de tabagisme. Une évaluation diagnostique exhaustive a été réalisée avec des tests de laboratoire, une bronchoscopie, une tomodensitométrie et une échocardiographie, mais l’étiologie n’a pas été trouvée. Cependant, l’artériographie bronchique a montré des artères bronchiques droites et gauches tortueuses et dilatées et une fistule bronchovasculaire a été démontrée in vivo comme étant l’origine de l’hémoptysie du patient.
La maladie de Dieulafoy est une anomalie vasculaire caractérisée par la présence d’une artère dysplasique tortueuse dans la sous-muqueuse. Le chirurgien français Georges Dieulafoy l’a décrite pour la première fois en 1898 comme une cause d’hémorragie gastro-intestinale dans l’estomac,7 mais elle a été identifiée dans d’autres parties du corps, y compris les voies respiratoires.8 En fait, la maladie de Dieulafoy bronchique est extrêmement rare, et on ne sait toujours pas si l’origine de l’anomalie est congénitale ou acquise, bien que l’on pense que l’âge et le tabagisme ont une influence sur la survenue de la maladie.9 En outre, le facteur déclenchant de la rupture du vaisseau est inconnu. D’autre part, bien que la bronchite soit une étiologie de l’hémoptysie, la question de savoir si cette entité est suffisante à elle seule pour provoquer une hémoptysie massive est controversée et de nombreux cliniciens pensent que d’autres facteurs doivent être présents pour qu’une hémoptysie massive se produise dans le cadre d’une bronchite seule.2 Menchini et al. ont rapporté une cohorte rétrospective de 35 patients présentant une maladie broncho-pulmonaire liée au tabagisme et sans comorbidité associée, qui ont été orientés vers une embolisation pour mettre fin à l’hémoptysie. L’angiographie des artères bronchiques a révélé une hypervascularisation modérée ou sévère chez 28 (80 %) patients et aucune différence statistique n’a été observée entre les résultats angiographiques et la sévérité de la BPCO, la consommation de tabac ou la quantité de saignement.10 Il a alors suspecté la maladie de Dieulafoy dans ces cas. Par conséquent, les hémoptysies récurrentes et massives causées par une hypervascularisation au sein de la paroi bronchique due à une inflammation chronique des voies respiratoires dans un contexte d’antécédents de tabagisme pourraient être expliquées par une forme acquise de cette entité.
En ce qui concerne le diagnostic de la maladie de Dieulafoy de la bronche, la bronchoscopie peut montrer une petite lésion nodulaire sessile, non pulsatile, souvent avec un capuchon blanc, et une muqueuse apparemment normale8. Parfois, l’aspect bronchoscopique n’est pas diagnostique car le site où le vaisseau anormal s’ouvre dans la bronche est généralement un défaut muqueux ponctuel entouré d’une muqueuse d’apparence normale et ce petit défaut n’est souvent pas visible sur la bronchoscopie en raison de l’accumulation de sang ou du remplissage de la lumière bronchique par des caillots. C’est ce qui s’est produit dans notre cas. La maladie de Dieulafoy bronchique ne peut être définitivement diagnostiquée que par un examen histopathologique11 ; cependant, la biopsie bronchique dans de tels cas peut entraîner une hémorragie grave.12 De plus, la réalisation d’une biopsie ne serait pas utile dans ce contexte, car le diagnostic de la maladie de Dieulafoy bronchique devrait être basé sur l’examen pathologique d’une large résection chirurgicale du poumon.9 L’échographie endobronchique peut être utile pour détecter la nature vasculaire de la lésion,13 mais elle n’était pas disponible dans notre hôpital. Hope-Gill et al. recommandent l’artériographie bronchique comme l’investigation initiale la plus appropriée dans ces cas.14 Il n’y a pas de critères angiographiques spécifiques pour diagnostiquer la maladie de Dieulafoy, mais la découverte d’une artère tortueuse et ectatique est suggestive de cette condition. L’embolisation sélective a été proposée comme méthode pour arrêter le saignement,14, 15 et ce n’est que dans quelques cas que le patient doit subir une résection chirurgicale.4 Récemment, Dalar et al. ont proposé la coagulation au plasma d’argon de ces lésions.16
Nous avons décrit un cas particulier d’hémoptysie massive et récurrente sans comorbidité associée, à l’exception du tabagisme. Les artères bronchiques tortueuses et dilatées et la fistule bronchovasculaire que nous avons trouvées dans le contexte d’une hypervascularisation pourraient être une forme acquise de la maladie de Dieulafoy, ce qui expliquerait l’ampleur du saignement.10 La survenue de ce fait lors de l’artériographie bronchique est extrêmement rare. A notre connaissance, une image d’un tel saignement actif à travers la fistule bronchovasculaire n’a jamais été démontrée auparavant.
Conclusion
De nos jours, la maladie de Dieulafoy devrait toujours être incluse dans le diagnostic différentiel de tout patient présentant une hémoptysie massive et récurrente. Nous avons alors envisagé cette possibilité étant donné l’absence de comorbidité chez notre patient, à l’exception d’un antécédent de tabagisme. Étant donné que la consommation de tabac entraîne à long terme une hypervascularisation de la paroi bronchique, secondaire à l’inflammation chronique des voies respiratoires dans le cadre d’une bronchite, nous pensons que cette maladie pourrait être plus fréquente que ne le suggèrent les rapports de la littérature. Bien que l’excision de la partie affectée du poumon soit l’étalon-or pour le diagnostic histopathologique définitif de la maladie de Dielafoy, la chirurgie n’est l’option que dans les cas récurrents et incontrôlés. L’artériographie bronchique comme méthode de diagnostic devrait être le choix privilégié plutôt que la bronchoscopie lorsque la maladie de Dieulafoy est suspectée, afin d’éviter complètement les procédures de biopsie dangereuses et inutiles.
Conflits d’intérêts
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Divulgations éthiquesProtection des sujets humains et animaux
Les auteurs déclarent qu’aucune expérience n’a été réalisée sur des humains ou des animaux pour cette étude.
Confidentialité des données
Les auteurs déclarent qu’aucune donnée de patient n’apparaît dans cet article.
Droit à la vie privée et consentement éclairé
Les auteurs déclarent qu’aucune donnée de patient n’apparaît dans cet article.
Reçu le 20 mars 2015
Accepté le 23 juin 2015
.