Nom commun : queue d’hirondelle tigrée orientale Nom scientifique : Papilio (Pterourus) glaucus Linnaeus (Insecta : Lepidoptera : Papilionidae)
La queue d’hirondelle tigrée orientale Papilio glaucus Linnaeus est probablement notre queue d’hirondelle la plus reconnaissable dans l’est des États-Unis. Elle est admirée par les jardiniers de papillons et chérie par les jeunes collectionneurs de papillons. Le premier dessin d’une queue d’hirondelle nord-américaine était un mâle de queue d’hirondelle tigrée et a été dessiné en 1587 par John White qui était le commandant de la troisième expédition de Sir Walter Raleigh en Amérique du Nord (Holland 1949, Opler et Krizek 1984). La popularité du machaon tigré de l’Est est évidente si l’on en juge par son utilisation sur deux timbres-poste des États-Unis (Figure 1).
Figure 1. Timbres-poste américains présentant des quenouilles tigrées de l’Est, Papilio glaucus Linnaeus.
Nomenclature (Back to Top)
Linnaeus a regroupé certaines quenouilles et d’autres papillons sous le nom de genre Papilio (Tyler 1975). Papilio est le mot latin pour papillon. Le nom de sous-genre Pterourus provient des racines grecques « ptero » pour aile et « ura » pour queue (Borror 1960).
Il existe un désaccord sur la classification générique des swallowtails (Hancock 1983, Miller 1987). Certains auteurs (par exemple, Tyler et al. 1994, Minno et al. 2005) suivent le système qui élève le sous-genre Pterourus au statut générique tel que proposé par Hancock (1983). Le nom Papilio étant encore très largement utilisé dans les sources accessibles au public, il sera utilisé ici à la place de Pterourus pour des raisons pratiques.
Distribution (Back to Top)
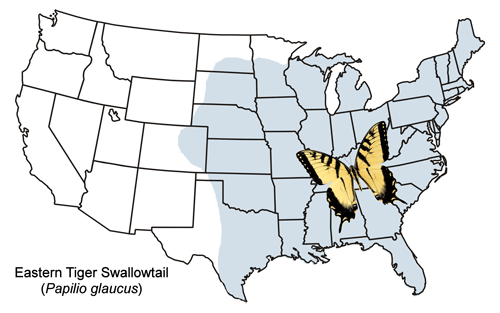
Le machaon tigré de l’Est est largement distribué de la Nouvelle-Angleterre vers l’ouest, en passant par le sud de la région des Grands Lacs et la plupart des États des Grandes Plaines (avec quelques mentions au Colorado) et vers le sud jusqu’au Texas et à la Floride (Figure 2). Dans le nord des États-Unis et le sud du Canada, le machaon tigré de l’Est est sympatrique (présent dans la même zone géographique) avec le machaon tigré du Canada, Papilio canadensis, qui était autrefois considéré comme une sous-espèce de Papilio glaucus (p. ex. Emmel 1975, Scott 1986). Dans cette zone sympatrique, certains hybrides se produisent (Hagen et al. 1991).
Figure 2. Carte de distribution de Papilio glaucus Linnaeus.
Description (Back to Top)
Adultes : Le machaon tigré de l’Est est une grande espèce dont l’envergure des ailes varie de 7,9 à 14,0 cm (environ 3,12 à 5,5 pouces) (Pyle 1981). Les adultes sont jaunes avec quatre bandes noires sur les ailes avant (figures 3 et 4). La bande la plus interne est alignée avec la bande médiane de l’aile postérieure. Les bords des ailes sont noirs avec une rangée de taches jaunes.
Figure 3. Queue d’hirondelle tigrée adulte, Papilio glaucus Linnaeus (ailes déployées, montrant la surface dorsale). Photographie de Donald W. Hall, Université de Floride.
Figure 4. Queue d’hirondelle tigrée adulte, Papilio glaucus Linnaeus (ailes repliées, montrant la surface ventrale). Photographie de Donald W. Hall, Université de Floride.
Certains quenouilles tigrées femelles sont de couleur sombre avec une rangée marginale de taches jaunes (Figure 5). De faibles vestiges des rayures typiques des quenouilles tigrées sont visibles sur le dessous des ailes antérieures de la forme sombre (Figure 6). Les ailes postérieures de la forme sombre sont bleu poudreux sur le dessus, avec une bande noire ondulée qui divise les zones bleu poudreux. Cette bande est absente chez les femelles de Papilio troilus L., qui peuvent autrement ressembler superficiellement à des quenouilles tigrées foncées. En outre, les taches marginales de Papilio troilus sont typiquement bleu-vert plutôt que jaunes.
Chez les papillons, les chromosomes sexuels sont à l’opposé de ceux des mammifères. Les papillons femelles constituent le sexe hétérogame (XY), et les mâles sont homogames (XX). Les femelles jaunes de Papilio glaucus donnent naissance à des femelles jaunes, et les femelles foncées à des femelles foncées, ce qui indique que le gène de la couleur se trouve sur le chromosome Y (Scriber et al.1995).
Figure 5. Queue d’hirondelle tigrée femelle sombre, Papilio glaucus Linnaeus (ailes déployées, montrant la surface dorsale). Photographie de Donald W. Hall, Université de Floride.
Figure 6. Queue d’hirondelle tigrée femelle sombre, Papilio glaucus Linnaeus (ailes repliées, montrant la surface ventrale avec des rayures caractéristiques). Photographie de Donald W. Hall, Université de Floride.
Les femelles sombres sont considérées comme des mimiques batesiennes (comestibles) de la queue d’hirondelle vénéneuse pipevine, Battus philenor (L.). (http://entnemdept.ufl.edu/creatures/bfly/pipevine_swallowtail.htm) (Brower 1958).
Œufs : les œufs sont verts (Minno et Minno 1999).
Larves : les larves adultes mesurent jusqu’à 6,4 cm (environ 2,5 pouces) de longueur (Minno et al. 2005). Les trois premiers stades sont brun foncé avec une selle blanche et ressemblent à des fientes d’oiseaux (Minno et Minno 1999, Wagner 2005). Les larves des quatrième et cinquième stades sont vertes avec un thorax gonflé et une bande transversale de points bleu pâle sur chaque segment abdominal (Figures 7 et 8). Il existe une bande transversale noire bordée de jaune à l’avant entre le premier et le deuxième segment abdominal qui est généralement cachée dans le pli segmentaire. Les larves ont également une seule paire de faux ocelles sur le métathorax. Les ocelles sont jaunes annelés de noir et contiennent un point bleu plus petit bordé de noir et une ligne noire mésad (vers la ligne médiane du dos) du point bleu. L’osmeterium est orange (Minno et al. 2005). Les larves de quatrième stade conservent la selle blanche (figure 7).
Figure 7. Larve de quatrième stade larvaire du machaon tigré, Papilio glaucus Linnaeus montrant la selle blanche. Photographie de Donald W. Hall, Université de Floride.
Figure 8. Larve de dernier stade larvaire du machaon tigré, Papilio glaucus Linnaeus. Photographie de Jerry F. Butler, Université de Floride.
Pupes : Les nymphes sont de couleur feu avec une bande latérale brun foncé ou noire et une bande dorsale brune (figure 9).
Figure 9. Nymphe du machaon tigré, Papilio glaucus Linnaeus. Photographie de Jerry F. Butler, Université de Floride.
Cycle de vie (Retour en haut)
Il y a deux vols dans la partie nord de l’aire de répartition et au moins trois et peut-être quatre vols en Floride (Scriber 1996). Le premier vol en Floride commence fin février ou début mars. Les adultes recherchent du nectar dans une variété de fleurs. Ils sirotent également de l’eau et des minéraux dans la boue (Berger et Lederhouse 1985). Les mâles patrouillent souvent au niveau de la cime des arbres et descendent en piqué à des niveaux inférieurs pour intercepter les femelles pour l’accouplement.
Les œufs sont pondus individuellement et généralement sur la surface supérieure des feuilles. Les larves nouvellement écloses mangent souvent la coquille de leurs œufs (Scriber 1996). Dans les œufs de Lépidoptères, une petite quantité de vitellus reste piégée entre deux des membranes embryonnaires (amniotique et séreuse) qui demeurent à l’intérieur des coquilles d’œufs après l’éclosion. Le jaune d’œuf résiduel sert de premier repas à la larve (Imms 1957). Ce comportement peut également réduire la détection par les prédateurs (Lederhouse 1990) qui pourraient être attirés par la coquille d’œuf vide.
Les larves filent un tapis de soie sur une feuille qui provoque l’enroulement des bords de la feuille vers le haut, mais elles ne produisent pas un enroulement complet de la feuille. La larve se repose sur le tapis de soie. Les larves de stade moyen à avancé se déplacent du site de repos vers d’autres parties de la plante pour se nourrir et reviennent sur le tapis de soie pour se reposer (Scriber 1996).
Les feuilles mâchées sont coupées au niveau des pétioles et laissées tomber de la plante peut-être pour réduire l’attraction des parasitoïdes qui peuvent être attirés par les produits chimiques volatils émanant des feuilles mâchées ou pour réduire la prédation par les oiseaux qui localisent leurs proies en cherchant les feuilles endommagées (Lederhouse 1990, Scriber 1996). Les larves jettent leurs excréments avec leurs mandibules. Ce comportement peut également réduire la détection par les prédateurs ou les parasitoïdes (Lederhouse 1990, Scriber et al. 1995).
Après que les larves adultes aient cessé de se nourrir, elles passent à une coloration brun-verdâtre ou brun-chocolat et errent le long des troncs d’arbres et généralement sur la litière de feuilles où elles sont très cryptiques. Elles se nymphosent souvent sur la face inférieure des brindilles ou des feuilles mortes sur le sol (West et Hazel 1979). La pupe est le stade d’hivernage (Minno et al. 2005).
Hôtes (Retour en haut de page)
De nombreuses espèces d’arbres et d’arbustes dans au moins sept familles sont utilisées comme hôtes (Opler et Malikul 1998, Scott 1986). Dans la péninsule de Floride, le laurier (Magnolia virginiana ) est l’hôte privilégié et semble être le seul hôte dans la moitié sud de la péninsule (Scriber 1986). Le laurier pousse dans les zones humides et peut être distingué des espèces de Persea (Lauraceae) d’apparence similaire, par les cicatrices stipulaires qui entourent complètement le rameau (Figure 10) et le glauque (revêtement fin, cireux, blanchâtre) de la face inférieure des feuilles de Magnolia virginiana (Figure 11) – caractéristiques qui manquent aux espèces de Persea. En outre, les fleurs, les fruits et les graines de Magnolia virginiana sont distinctifs (Figure 11).
Figure 10. Tiges de Magnolia virginiana (L.) (Magnoliaceae) présentant des cicatrices stipulaires et la baie rouge Persea borbonia, d’apparence similaire, qui ne présente pas de cicatrices stipulaires. Photographie de Donald W. Hall, Université de Floride.
Figure 11. Laurier doux, Magnolia virginiana (L.) (Magnoliaceae) montrant la face inférieure glauque caractéristique de la feuille (médaillon a), de la fleur (médaillon b) et des graines (flèche). Photographie de Donald W. Hall, Université de Floride.
Tulipier, Liriodendron tulipifera Linnaeus (Magnoliaceae) (Figure 12), cerisier noir, Prunus serotina Ehrh. (Rosaceae) (Figure 13), le frêne blanc, Fraxinus americana Linnaeus (Oleaceae) (Figure 14), et le frêne pop, Fraxinus caroliniana Mill. (Oleaceae), sont parfois utilisés dans le nord de la Floride (Minno et Minno 1999). Pour des photographies de Fraxinus caroliniana, voir sa page d’espèce sur le site web Atlas of Florida Plants (Wunderlin et al. 2019). Les frênes peuvent être différenciés des caryers (espèces Carya), très similaires, par la disposition opposée de leurs feuilles sur les tiges par rapport à la disposition alternée des feuilles du caryer.
Figure 12. Tulipier, Liriodendron tulipifera L. (Magnoliaceae). Photographie de Donald W. Hall, Université de Floride.
Figure 13. Cerisier noir, Prunus serotina Ehrh., feuillage et fleurs. Photographie de Jerry F. Butler, Université de Floride.
Figure 14. Frêne blanc, Fraxinus americana Linnaeus (Oleaceae). Photo prise par Donald W. Hall, Université de Floride.
Références choisies (Retour en haut)
- Berger TA, Lederhouse RC. 1985. La formation de flaques d’eau par des mâles et des femelles célibataires de quenouilles tigrées, Papilio glaucus L. (Papilionidae). Journal de la société des lépidoptéristes 39 : 339-340.
- Borror DJ. 1960. Dictionnaire des racines des mots et de leurs formes combinées : Compilé à partir du grec, du latin et d’autres langues, avec une référence spéciale aux noms biologiques et scientifiques. Mayfield Publishing Company. Palo Alto, Californie. 134 pp.
- Brower J. 1958. Études expérimentales du mimétisme chez certains papillons nord-américains : Partie II. Battus philenor et Papilio troilus, P. polyxenes et P. glaucus. Evolution 12(2) : 123-136.
- Emmel J. 1975. Subfamily Papilioninae. pp. 390-402. In : Howe WH. Les papillons d’Amérique du Nord. Doubleday & Company. Garden City, New York. 633 pp.
- Hagen RH, Lederhouse RC, Bossart JL, Scriber JM. 1991. Papilio canadensis et P. glaucus (Papilionidae) sont des espèces distinctes. Journal of the Lepidopterists’ Society 45(4) : 245-258.
- Hancock DL. 1983. Classification des Papilionidae (Lepidoptera) : Une approche phylogénétique. Smithersia 2 : 1-48.
- Holland WJ. 1949. Le livre des papillons. Doubleday & Company. Garden City, New York. 424 pp. + 77 planches.
- Imms A.D. 1957. Un manuel général d’entomologie : Incluant l’anatomie, la physiologie, le développement et la classification des insectes. p. 212. Neuvième édition (entièrement révisée par Richards OW, Davies RG). Methuen. Londres. 886 pp.
- Miller JS. 1987. Études phylogénétiques dans les Papilioninae (Lepidoptera : Papilionidae). Bulletin du musée américain d’histoire naturelle 186(4) : 365-512.
- Minno M, Butler J, Hall D. 2005. Les chenilles des papillons de Floride et leurs plantes hôtes. Presse universitaire de Floride. Gainesville, Floride. 341 pp.
- Minno MC, Minno M. 1999. Florida Butterfly Gardening. University Press of Florida. Gainesville, Floride. 210 pp.
- Lederhouse RC. 1990. Éviter la chasse : Les défenses primaires des chenilles de lépidoptères. pp. 175-189. Dans Evans DL, Schmidt JO. (eds). Insect Defenses : Adaptive Mechanisms and Strategies of Prey and Predators. State University of New York Press. Albany, New York. 482 pp.
- Opler PA, Krizek GO. 1984. Butterflies East of the Great Plains. The Johns Hopkins University Press. Baltimore, Maryland.
- Opler PA, Malikul V. 1998. Guide de terrain des papillons de l’Est. Guides de terrain Peterson. Houghton Mifflin Company. New York, New York. 486 pp.
- Pyle RM. 1981. Le guide de terrain de la société Audubon sur les papillons nord-américains. Alfred A. Knopf. New York, New York. 916 pp.
- Scott JA. 1986. Les papillons d’Amérique du Nord. Stanford University Press. Stanford, CA.
- Scriber JM. 1986. Origines des capacités d’alimentation régionales chez le papillon queue d’aronde tigrée : monophagie écologique et la sous-espèce Papilio glaucus australis en Floride. Oecologia 71 : 94-103.
- Scriber JM. 1996. Histoires de tigre : histoire naturelle des swallowtails indigènes nord-américains. American Entomologist 42 : 19-32.
- Scriber JM, Tsubaki Y, Lederhouse RC, Eds. 1995. Les papillons à queue d’hirondelle : Leur écologie et leur biologie évolutive. Éditeurs scientifiques. Gainesville, FL.
- Tyler HA. 1975. The Swallowtail Butterflies of North America. Naturegraph Publishers. Healdsburg, Californie. 192 pp.
- Tyler HA, Brown KS Jr, Wilson KH. 1994. Swallowtail Butterflies of the Americas. Scientific Publishers. Gainesville, Floride. 376 pp.
- West DA, Hazel WN. 1979. Sites de nymphose naturels des papillons à queue d’aronde (Lepidoptera : Papilionidae) : Papilio polyxenes Fabr., P. glaucus L. et Battus philenor (L.). Entomologie écologique 4 : 387-392.
- Wagner DL. 2005. Les chenilles de l’est de l’Amérique du Nord. Princeton University Press. Princeton, New Jersey. 512 pp.
- Wunderlin RP, Hansen BF, Franck AR, Essig FB. 2019. Atlas des plantes de Floride. Institut de botanique systématique. Université de Floride du Sud. Tampa, Floride. (http://www.florida.plantatlas.usf.edu/) (consulté le 19 mars 2020)
.