La loi de Beer-Lambert (également appelée loi de Beer) est une relation entre l’atténuation de la lumière à travers une substance et les propriétés de cette substance. Dans ce billet de blog, les définitions de la transmittance et de l’absorbance de la lumière par une substance sont d’abord introduites, suivies d’une explication de la loi de Beer-Lambert.
Qu’est-ce que la transmittance et l’absorbance ?
Considérons une lumière monochromatique transmise à travers une solution ; avec une intensité incidente de I0 et une intensité transmise de I (figure 1).
La transmittance, T, de la solution est définie comme le rapport de l’intensité transmise, I, sur l’intensité incidente, I0:
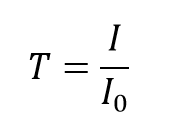
et prend des valeurs comprises entre 0 et 1. Cependant, elle est plus communément exprimée en pourcentage de transmittance :
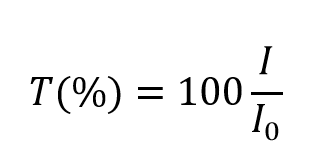
L’absorbance, A, de la solution est liée à la transmittance et aux intensités incidente et transmise par les relations suivantes :
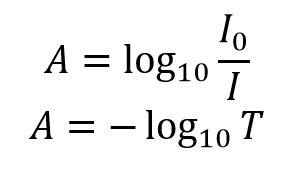
L’absorbance a une relation logarithmique avec la transmittance ; une absorbance de 0 correspondant à une transmittance de 100% et une absorbance de 1 correspondant à une transmittance de 10%. D’autres valeurs de paires de transmittance et d’absorbance sont données dans le tableau 1. Une démonstration visuelle de l’effet que l’absorbance d’une solution a sur l’atténuation de la lumière qui la traverse est présentée à la figure 2, où un laser de 510 nm est passé à travers trois solutions de Rhodamine 6G d’absorbance différente.
Tableau 1 : valeurs d’absorbance et de transmittance :
| Absorbance | Transmittance |
|---|---|
| 0 | 100% | 1 | 10% | 2 | 1% | 3 | 0.1% |
| 4 | 0,01% |
| 5 | 0.001% |

Figure 2 : atténuation d’un laser de 510 nm à travers trois solutions de Rhodamine 6G ayant des valeurs d’absorbance différentes à 510 nm. La lueur jaune est l’émission de fluorescence à ~560 nm.
L’absorbance est une quantité sans dimension et devrait, par conséquent, être sans unité. Cependant, il est assez fréquent de voir des unités d’UA énoncées après l’absorbance, dont on peut dire qu’elles représentent soit des unités arbitraires, soit des unités d’absorbance. Ces unités sont redondantes et doivent être évitées. Un autre cas fréquent est l’utilisation du terme densité optique ou DO à la place de l’absorbance. La densité optique est un terme plus ancien qui, dans le contexte de la spectroscopie d’absorption, est synonyme d’absorbance ; cependant, l’utilisation de la densité optique à la place de l’absorbance est déconseillée par l’UICPA1.
Qu’est-ce que la loi de Beer-Lambert ?
La loi de Beer-Lambert est une relation linéaire entre l’absorbance et la concentration, le coefficient d’absorption molaire et le coefficient optique d’une solution :

Le coefficient d’absorption molaire est une propriété dépendante de l’échantillon et est une mesure de la force d’absorption de l’échantillon à une longueur d’onde particulière de la lumière. La concentration est simplement les moles L-1 (M) de l’échantillon dissous dans la solution, et la longueur est la longueur de la cuvette utilisée pour la mesure de l’absorbance et est généralement de 1 cm.
La loi de Beer-Lambert stipule qu’il existe une relation linéaire entre la concentration et l’absorbance de la solution, ce qui permet de calculer la concentration d’une solution en mesurant son absorbance. Pour démontrer cette dépendance linéaire, cinq solutions de rhodamine B dans l’eau ont été mesurées à l’aide du spectrophotomètre DS5 à double faisceau (Figure 3a) et, à partir de ces spectres d’absorption, une courbe d’étalonnage linéaire de l’absorbance en fonction de la concentration a été créée (Figure 3b). En utilisant cette courbe d’étalonnage, la concentration d’une solution de Rhodamine B inconnue peut être déterminée en mesurant son absorbance, ce qui est la principale utilité de la loi de Beer-Lambert.
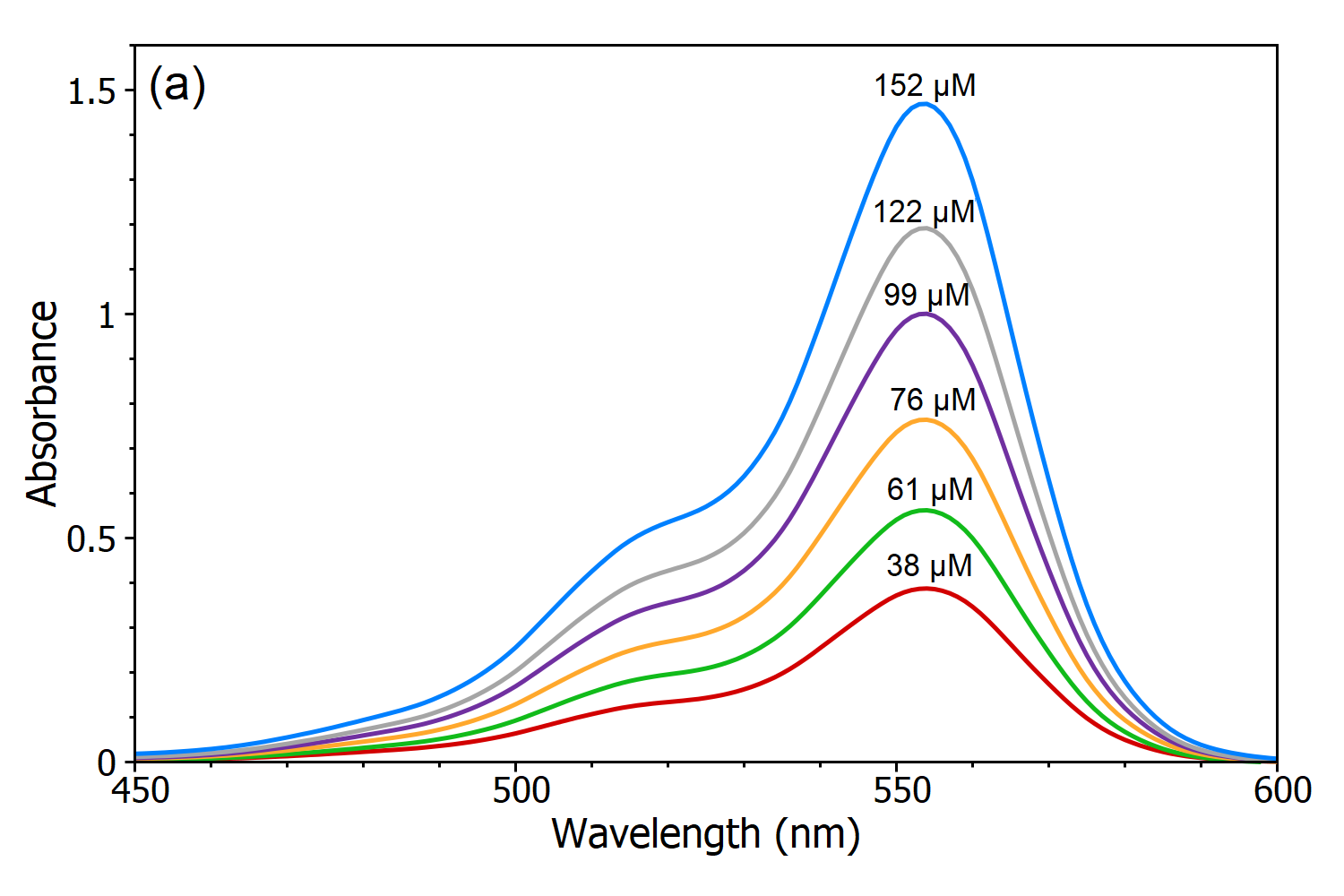

Figure 3 (a) : Spectres d’absorption de solutions de Rhodamine B à différentes concentrations dans l’eau, mesurés à l’aide du spectrophotomètre à double faisceau DS5. (b) Courbe d’étalonnage de la Rhodamine B dans l’eau à mesurée à λmax.
Pour plus d’informations sur la théorie de la spectroscopie d’absorption, consultez la section des questions fréquemment posées sur notre blog.