
J. J. Thomson a porté la science vers de nouveaux sommets avec sa découverte en 1897 de l’électron – la première particule subatomique.
Il a également trouvé la première preuve que les éléments stables peuvent exister sous forme d’isotopes et a inventé l’un des outils les plus puissants de la chimie analytique – le spectromètre de masse.
Débuts : École et université
Joseph John Thomson est né le 18 décembre 1856 à Manchester, en Angleterre, au Royaume-Uni.
Son père, Joseph James Thomson, dirigeait une librairie spécialisée qui était dans sa famille depuis trois générations. Sa mère, Emma Swindells, était issue d’une famille propriétaire d’une entreprise de coton.
Dès son plus jeune âge, Joey, que l’on appellera plus tard J. J., s’intéresse profondément aux sciences. À l’âge de 14 ans, il devint étudiant à Owens College, l’université de Manchester, où il étudia les mathématiques, la physique et l’ingénierie.
Très timide, ses parents espéraient qu’il devienne apprenti ingénieur dans une entreprise de locomotives. Ces espoirs furent anéantis par le décès de son père, alors que J. J. avait 16 ans. Les frais d’apprentissage d’ingénieur étaient élevés, et sa mère ne pouvait pas les payer.
Ce malheur a finalement profité à la science, car J. J. devait trouver des fonds pour poursuivre ses études. En 1876, à 19 ans, il a obtenu ce financement, non pas en ingénierie, mais en mathématiques à l’Université de Cambridge. Quatre ans plus tard, il a obtenu son diplôme avec mention très bien.
Thomson a continué à étudier à Cambridge et en 1882, il a remporté le prix Adam, l’un des prix de mathématiques les plus recherchés de l’université. En 1883, il obtient une maîtrise en mathématiques.
Premiers travaux de recherche
Atomes
Lorsque Thomson a commencé à travailler en tant qu’étudiant chercheur, personne n’avait une image claire de ce à quoi les atomes pouvaient ressembler. Thomson a décidé de les visualiser comme un anneau de fumée et de voir où les mathématiques décrivant une telle image le mèneraient. Ce travail, pour lequel il a reçu à la fois le prix Adam et sa maîtrise, avait pour titre A Treatise on the Motion of Vortex Rings. Bien que le titre et les premiers chapitres puissent laisser penser que les mathématiques appliquées en étaient le thème principal, les titres des dernières sections sont révélateurs :
- Pression d’un gaz. Loi de Boyle
- Effusion thermique
- Ebauche d’une théorie chimique
- Théorie de la quantification
- Valence des différents éléments
Thomson poussait son puissant esprit mathématique vers une compréhension plus profonde de la matière.
Électricité et magnétisme
En plus des atomes, Thomson a commencé à s’intéresser sérieusement aux équations de James Clerk Maxwell, qui avaient révélé que l’électricité et le magnétisme étaient des manifestations d’une seule force – la force électromagnétique – et avaient révélé que la lumière était une onde électromagnétique.
En 1893, à l’âge de 36 ans, Thomson a publié Notes on Recent Researches in Electricity and Magnetism, en s’appuyant sur les travaux de Maxwell. Son livre est parfois décrit comme le « volume 3 des équations de Maxwell »
 « J’ose donner une autre méthode pour considérer les processus se produisant dans le champ électrique, que j’ai souvent trouvée utile et qui est, d’un point de vue mathématique, équivalente à la théorie de Maxwell. »
« J’ose donner une autre méthode pour considérer les processus se produisant dans le champ électrique, que j’ai souvent trouvée utile et qui est, d’un point de vue mathématique, équivalente à la théorie de Maxwell. »
Les contributions les plus significatives de Thomson à la science
Découverte de l’électron – La première particule subatomique
En 1834, Michael Faraday a inventé le mot ion pour décrire les particules chargées qui étaient attirées par des électrodes chargées positivement ou négativement. Ainsi, à l’époque de Thomson, on savait déjà que les atomes sont associés d’une manière ou d’une autre à des charges électriques, et que les atomes pouvaient exister sous des formes ioniques, portant des charges positives ou négatives. Par exemple, le sel de table est constitué d’atomes de sodium et de chlore ionisés.
Na+ : Un ion sodium avec une seule charge positive
Cl- : Un ion chlorure avec une seule charge négative
En 1891, George Johnstone Stoney a inventé le mot électron pour représenter l’unité fondamentale de la charge électrique. Il ne proposait cependant pas que l’électron existe en tant que particule à part entière. Il pensait qu’il représentait la plus petite unité de charge qu’un atome ionisé pouvait avoir.
Les atomes étaient encore considérés comme indivisibles.
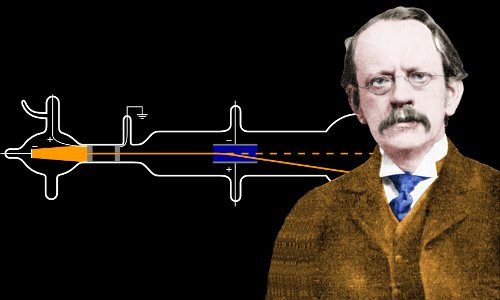
En 1897, à 40 ans, Thomson réalise une expérience désormais célèbre avec un tube cathodique.

Tube à rayons cathodiques, similaire à celui utilisé par J. J. Thomson. L’air contenu dans le tube en verre creux est pompé pour créer un vide. Des électrons sont produits à la cathode par une haute tension et se déplacent dans le vide, créant une lueur verte lorsqu’ils frappent le verre à l’extrémité. Ici, une croix métallique projette une ombre, établissant que les électrons se déplacent en ligne droite et ne peuvent pas traverser le métal. Image de Zátonyi Sándor.
Lorsque Thomson a permis à ses rayons cathodiques de voyager dans l’air plutôt que dans le vide habituel, il a été surpris de la distance qu’ils pouvaient parcourir avant d’être arrêtés. Cela lui a suggéré que les particules à l’intérieur des rayons cathodiques étaient plusieurs fois plus petites que ce que les scientifiques avaient estimé être des atomes.
Donc, les particules des rayons cathodiques étaient plus petites que les atomes ! Qu’en est-il de leur masse ? Avaient-elles une masse typique, par exemple, d’un atome d’hydrogène ? – la plus petite particule alors connue.
Pour estimer la masse d’une particule cathodique et découvrir si sa charge était positive ou négative, Thomson a dévié des rayons cathodiques avec des champs électriques et magnétiques pour voir dans quelle direction ils étaient déviés et à quelle distance ils étaient tirés hors de leur trajectoire. Il savait que la taille de la déviation le renseignerait sur la masse de la particule et que la direction de la déviation lui indiquerait la charge des particules. Il a également estimé la masse en mesurant la quantité de chaleur générée par les particules lorsqu’elles frappaient une cible.
Thomson a utilisé une chambre à nuage pour établir qu’une particule de rayon cathodique porte la même quantité de charge (c’est-à-dire une unité) qu’un ion d’hydrogène.
De ces expériences, il a tiré trois conclusions révolutionnaires :
- Les particules de rayon cathodique sont chargées négativement.
- Les particules cathodiques sont au moins mille fois plus légères qu’un atome d’hydrogène.
- Quelle que soit la source utilisée pour les générer, toutes les particules cathodiques ont une masse identique et une charge identique.
2 300 ans plus tôt, dans la Grèce antique, Démocrite avait utilisé son intellect pour déduire l’existence des atomes.
En 1808, John Dalton avait ressuscité l’idée de Démocrite avec sa théorie atomique.
À l’époque de Thomson, les scientifiques étaient convaincus que les atomes étaient les plus petites particules de l’univers, les blocs de construction fondamentaux de tout.
Ces croyances furent brisées par les expériences de J. J. Thomson, qui prouvèrent l’existence d’une nouvelle particule fondamentale, beaucoup plus petite que l’atome : l’électron. Le monde ne serait plus jamais le même.
Les physiciens étaient désormais incités à étudier les particules subatomiques – des particules plus petites que l’atome. C’est ce qu’ils ont fait depuis, en essayant de découvrir les blocs de construction qui constituent les blocs de construction qui constituent les blocs de construction qui constituent les blocs de construction… de la matière.
Bien que de nombreux blocs de construction aient été découverts, l’électron de Thomson semble être une particule véritablement fondamentale qui ne peut être divisée davantage.
Thomson a reçu le prix Nobel de physique en 1906 pour sa découverte.

J. J. Thomson dans son laboratoire faisant fonctionner un tube cathodique. Bien qu’il ait été un brillant théoricien, un brillant concepteur d’expériences et un brillant interprète des résultats expérimentaux, Thomson était notoirement maladroit avec les appareils de laboratoire !
 « Comme les rayons cathodiques portent une charge d’électricité négative, qu’ils sont déviés par une force électrostatique comme s’ils étaient électrisés négativement, et qu’ils sont actionnés par une force magnétique exactement de la manière dont cette force agirait sur un corps électrisé négativement se déplaçant sur le trajet de ces rayons, je ne vois pas comment échapper à la conclusion qu’il s’agit de charges d’électricité négative portées par des particules de matière. »
« Comme les rayons cathodiques portent une charge d’électricité négative, qu’ils sont déviés par une force électrostatique comme s’ils étaient électrisés négativement, et qu’ils sont actionnés par une force magnétique exactement de la manière dont cette force agirait sur un corps électrisé négativement se déplaçant sur le trajet de ces rayons, je ne vois pas comment échapper à la conclusion qu’il s’agit de charges d’électricité négative portées par des particules de matière. »
L’atome comme un plum-pudding
Sur la base de ses résultats, Thomson a produit son célèbre (mais incorrect) modèle de plum-pudding de l’atome. Il s’est représenté l’atome comme un « pudding » uniformément chargé positivement à l’intérieur duquel les prunes (électrons) orbitent.
Invention du spectromètre de masse
En découvrant l’électron, Thomson s’est également dirigé vers l’invention d’un nouvel outil immensément important pour l’analyse chimique – le spectromètre de masse.
Dans sa forme la plus simple, un spectromètre de masse ressemble à un tube cathodique, mais son faisceau de particules chargées est constitué d’ions positifs plutôt que d’électrons. Ces ions sont déviés d’une trajectoire en ligne droite par des champs électriques/magnétiques. La quantité de déviation dépend de la masse de l’ion (les faibles masses sont plus déviées) et de sa charge (les charges élevées sont plus déviées).
En ionisant des matériaux et en les faisant passer dans un spectromètre de masse, on peut déduire les éléments chimiques présents dans le matériau en fonction de la déviation de leurs ions.
Chaque atome d’hydrogène n’a qu’un seul électron
En 1907, Thomson a établi à l’aide de diverses méthodes que chaque atome d’hydrogène n’a qu’un seul électron.
Découverte des isotopes des éléments stables
Bien que Thomson ait découvert l’électron, les scientifiques avaient encore beaucoup de chemin à parcourir pour parvenir à une compréhension même élémentaire de l’atome : les protons et les neutrons restaient à découvrir.
Malgré ces obstacles, Thomson a découvert en 1912 que les éléments stables pouvaient exister sous forme d’isotopes. En d’autres termes, le même élément pouvait exister avec des masses atomiques différentes.
Thomson a fait cette découverte lorsque son étudiant chercheur Francis Aston a tiré du néon ionisé à travers un champ magnétique et électrique – c’est-à-dire qu’il a utilisé un spectromètre de masse – et a observé deux déviations distinctes. Thomson en a conclu que le néon existe sous deux formes dont les masses sont différentes – c’est-à-dire des isotopes.
Aston a ensuite remporté le prix Nobel de chimie de 1922 pour avoir poursuivi ces travaux, découvert un grand nombre d’isotopes stables et découvert que toutes les masses des isotopes sont des multiples entiers de la masse de l’atome d’hydrogène.
Quelques détails personnels et la fin
En 1890, âgé de 33 ans, Thomson épouse Rose Elizabeth Paget, une jeune physicienne travaillant dans son laboratoire. Elle était la fille d’un professeur de médecine de Cambridge. Le couple a eu un fils, George, et une fille, Joan.
Humble et modeste, avec un sens de l’humour tranquille, sont probablement les meilleurs mots pour résumer la personnalité de Thomson.
Malgré sa modestie, il devient à 27 ans professeur Cavendish de physique expérimentale à Cambridge – un rôle occupé pour la première fois par James Clerk Maxwell. Dans son rôle de professeur Cavendish, il s’asseyait souvent pour faire des calculs sur la chaise que Maxwell lui-même avait autrefois occupée.
En plus de faire lui-même des découvertes remarquables, Thomson a ouvert la voie de la grandeur à un nombre important d’autres scientifiques. Un nombre remarquable de chercheurs de Thomson ont ensuite remporté des prix Nobel, notamment Charles T. R. Wilson, Charles Barkla, Ernest Rutherford, Francis Aston, Owen Richardson, William Henry Bragg, William Lawrence Bragg et Max Born.
Thomson avait 40 ans lorsqu’Ernest Rutherford est arrivé dans son laboratoire. Après la rencontre, Rutherford écrit à propos de Thomson :
« Il est très agréable en conversation et n’est pas du tout fossilisé. En ce qui concerne l’apparence, c’est un homme de taille moyenne, brun et assez jeune encore : il se rase, très mal, et porte ses cheveux plutôt longs. »
31 ans après que Thomson ait reçu le prix Nobel, son fils George l’a remporté. Le prix de George en 1937 était également pour des travaux sur les électrons, dont il a prouvé qu’ils pouvaient se comporter comme des ondes.
 « C’est un fait fascinant que le père et le fils aient donné les preuves les plus frappantes des propriétés apparemment contradictoires de l’électron : le père prouvant son caractère de particule, le fils son caractère d’onde… Thomson était extrêmement fier du succès de son fils et tentait d’assimiler les nouveaux résultats à ses anciennes convictions. »
« C’est un fait fascinant que le père et le fils aient donné les preuves les plus frappantes des propriétés apparemment contradictoires de l’électron : le père prouvant son caractère de particule, le fils son caractère d’onde… Thomson était extrêmement fier du succès de son fils et tentait d’assimiler les nouveaux résultats à ses anciennes convictions. »
Thomson a été fait chevalier en 1908, devenant Sir J. J. Thomson.
Le jardinage était son hobby.
J. J. J. Thomson est mort à l’âge de 83 ans, le 30 août 1940. Ses cendres ont été enterrées dans la Nef de l’abbaye de Westminster, rejoignant d’autres grands noms de la science comme Isaac Newton, Lord Kelvin, Charles Darwin, Charles Lyell et son ami et ancien chercheur Ernest Rutherford.
Auteur de cette page : Le Doc
Les images des scientifiques de cette page ont été améliorées numériquement et colorisées par ce site. © Tous droits réservés.
Citer cette page
Veuillez utiliser la citation suivante conforme à la norme MLA :
"J. J. Thomson." Famous Scientists. famousscientists.org. 27 Jul. 2015. Web. <www.famousscientists.org/j-j-thomson/>.
Publié par FamousScientists.org
Lecture complémentaire
J. J. Thomson
A Treatise on the Motion of Vortex Rings
MacMillan and Co. Londres, 1883
J. J. Thomson
Notes sur les recherches récentes en électricité et en magnétisme
Clarendon Press, 1893
J. J. Thomson
Sur les corps plus petits que les atomes
Popular Science Monthly, août, 1901
J. J. Thomson
Sur le nombre de corpuscules dans un atome
Philosophical Magazine, vol. 11, juin 1906. p. 769-781
Max Born
Note nécrologique de Sir J. J. Thomson
Proceedings of the Physical Society, 53 iii, 1942.
Abraham Pais
Niels Bohr’s Times : In Physics, Philosophy, and Polity
Clarendon Press, 1993
Images Creative Commons
Cathode Ray Tube by Zátonyi Sándor, Creative Commons Attribution-Share Alike 3.0 Unported.
Les images de l’époque de Bohr ont été utilisées pour la première fois dans le monde.