Strictement définie, l’ionisation est la perte complète d’un électron d’une espèce atomique ou moléculaire.L’espèce résultante est appelée un ion.

Dans les équations chimiques, la charge des ions est représentée par un exposant, comme dans cette réaction d’ionisation simple :
Les ions peuvent s’ioniser davantage :
Les ions chargés positivement sont souvent appelés cations.
Bien qu’en termes stricts l’ionisation se réfère à la formation d’un ion positif, dans l’usage normal, le mot inclut également la formation d’un ion négatif :
Les ions chargés négativement sont souvent appelés anions.
Ionisation directe des éléments
Les métaux forment généralement des cations et les non-métaux forment généralement des anions.Certains éléments, comme le carbone, l’or et les gaz nobles, ne forment pas facilement des ions.
Les métaux alcalins du groupe 1 du tableau périodique et les halogénures du groupe 17 s’ionisent très facilement.Les métaux alcalins n’ont besoin que de perdre un électron pour obtenir une enveloppe électronique complète : de même, les halogénures n’ont besoin que de gagner un électron pour y parvenir.Par exemple, le sodium et le chlore réagissent spontanément en s’ionisant pour former le composé ionique chlorure de sodium :
Potassium et eau réagissent en s’ionisant pour produire le composé ionique hydroxyde de potassium plus hydrogène :
Ionisation des molécules en solution
Les molécules de chlorure d’hydrogène gazeux s’ionisent facilement dans l’eau pour produire de l’acide chlorhydrique.
L’auto-ionisation
Dans l’eau, l’équilibre existe entre les molécules d’eau et les ions résultant de l’auto-ionisation de l’eau. (Voir amphiprotique.)
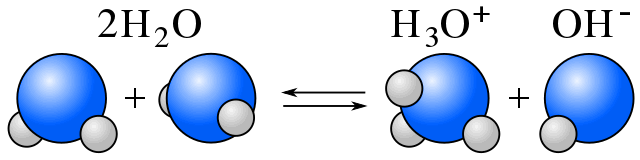
Ionisation dans le plasma
À très haute température, les électrons sont arrachés aux atomes pour former un plasma.Par exemple, dans la couronne solaire :
L’énergie nécessaire pour retirer un électron d’une espèce est son énergie d’ionisation.L’énergie nécessaire pour retirer un deuxième électron est la deuxième énergie d’ionisation ; pour en retirer un troisième, la troisième énergie d’ionisation, etc.
Exemples d’énergie d’ionisation
Les premières énergies d’ionisation des éléments de la troisième ligne du tableau périodique sont les suivantes :
Première énergie d’ionisation
| Élément | Energie de première ionisation (eV) |
|---|---|
| Sodium | 5.14 |
| Magnésium | 7,65 |
| Aluminium | 5,99 |
| Silicium | 8.15 |
| Phosphore | 10,49 | Soufre | 10,36 | Chlore | 12,97 | Argon | 15.76 |
Il est clair qu’il existe une tendance à l’augmentation de l’énergie d’ionisation en allant de gauche à droite dans le tableau périodique.Le graphique ci-dessous illustre cette tendance pour une plus large sélection d’éléments:
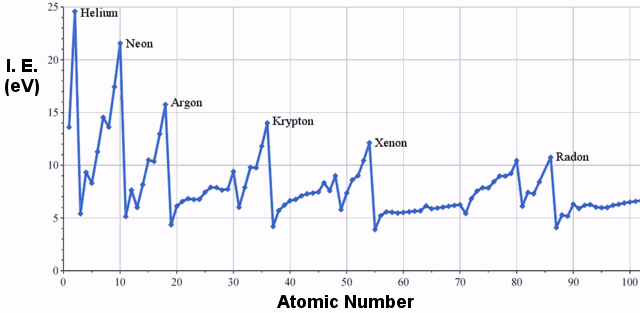

.