Objectifs d’apprentissage
- Identifier les types de récepteurs, leur composition moléculaire et les différences entre eux
Les récepteurs sont des molécules protéiques dans la cellule cible ou à sa surface qui fixent un ligand. Il existe deux types de récepteurs, les récepteurs internes et les récepteurs de surface cellulaire.
Récepteurs internes

Figure 1. Les molécules de signalisation hydrophobes diffusent généralement à travers la membrane plasmique et interagissent avec des récepteurs intracellulaires dans le cytoplasme. De nombreux récepteurs intracellulaires sont des facteurs de transcription qui interagissent avec l’ADN dans le noyau et régulent l’expression des gènes.
Les récepteurs internes, également appelés récepteurs intracellulaires ou cytoplasmiques, se trouvent dans le cytoplasme de la cellule et répondent aux molécules ligand hydrophobes qui sont capables de traverser la membrane plasmique. Une fois à l’intérieur de la cellule, nombre de ces molécules se lient à des protéines qui agissent comme régulateurs de la synthèse de l’ARNm (transcription) pour médier l’expression des gènes. L’expression génétique est le processus cellulaire de transformation des informations contenues dans l’ADN d’une cellule en une séquence d’acides aminés, qui forme finalement une protéine. Lorsque le ligand se lie au récepteur interne, un changement de conformation est déclenché, exposant un site de liaison à l’ADN sur la protéine. Le complexe ligand-récepteur se déplace dans le noyau, puis se lie à des régions régulatrices spécifiques de l’ADN chromosomique et favorise l’initiation de la transcription (figure 1). La transcription est le processus qui consiste à copier les informations contenues dans l’ADN d’une cellule dans une forme spéciale d’ARN appelée ARN messager (ARNm) ; la cellule utilise les informations contenues dans l’ARNm (qui se déplace dans le cytoplasme et s’associe aux ribosomes) pour lier des acides aminés spécifiques dans le bon ordre, produisant ainsi une protéine. Les récepteurs internes peuvent influencer directement l’expression des gènes sans avoir à transmettre le signal à d’autres récepteurs ou messagers.
Récepteurs de surface cellulaire
Les récepteurs de surface cellulaire, également appelés récepteurs transmembranaires, sont des protéines de surface cellulaire, ancrées dans la membrane (intégrales), qui se lient à des molécules ligand externes. Ce type de récepteur traverse la membrane plasmique et effectue une transduction du signal, dans laquelle un signal extracellulaire est converti en un signal intercellulaire. Les ligands qui interagissent avec les récepteurs de surface n’ont pas besoin de pénétrer dans la cellule qu’ils affectent. Les récepteurs de surface cellulaire sont également appelés protéines ou marqueurs spécifiques aux cellules car ils sont spécifiques à des types de cellules individuels.
Chaque récepteur de surface cellulaire possède trois composants principaux : un domaine de liaison au ligand externe, une région hydrophobe qui traverse la membrane et un domaine intracellulaire à l’intérieur de la cellule. Le domaine de liaison au ligand est également appelé domaine extracellulaire. La taille et l’étendue de chacun de ces domaines varient considérablement, selon le type de récepteur.
Parce que les protéines réceptrices de la surface cellulaire sont fondamentales pour le fonctionnement normal des cellules, il ne faut pas s’étonner qu’un dysfonctionnement de l’une de ces protéines puisse avoir de graves conséquences. Il a été démontré que des erreurs dans les structures protéiques de certaines molécules réceptrices jouent un rôle dans l’hypertension (pression artérielle élevée), l’asthme, les maladies cardiaques et le cancer.
Comment les virus reconnaissent un hôte
Contrairement aux cellules vivantes, de nombreux virus ne possèdent pas de membrane plasmique ni aucune des structures nécessaires au maintien de la vie. Certains virus sont simplement composés d’une enveloppe protéique inerte contenant de l’ADN ou de l’ARN. Pour se reproduire, les virus doivent envahir une cellule vivante, qui leur sert d’hôte, puis prendre le contrôle de l’appareil cellulaire de l’hôte. Mais comment un virus reconnaît-il son hôte ?
Les virus se lient souvent à des récepteurs de surface de la cellule hôte. Par exemple, le virus responsable de l’influenza humaine (grippe) se lie spécifiquement aux récepteurs des membranes des cellules du système respiratoire. Les différences chimiques des récepteurs de surface cellulaire entre les hôtes signifient qu’un virus qui infecte une espèce spécifique (par exemple, les humains) ne peut pas infecter une autre espèce (par exemple, les poulets).
Cependant, les virus ont de très petites quantités d’ADN ou d’ARN par rapport aux humains et, par conséquent, la reproduction virale peut se produire rapidement. La reproduction virale produit invariablement des erreurs qui peuvent entraîner des changements dans les virus nouvellement produits ; ces changements signifient que les protéines virales qui interagissent avec les récepteurs de la surface cellulaire peuvent évoluer de telle sorte qu’elles puissent se lier aux récepteurs d’un nouvel hôte. De telles modifications se produisent de manière aléatoire et assez souvent dans le cycle de reproduction d’un virus, mais elles n’ont d’importance que si un virus doté de nouvelles propriétés de liaison entre en contact avec un hôte approprié. Dans le cas de la grippe, cette situation peut se produire dans des environnements où les animaux et les personnes sont en contact étroit, comme les exploitations avicoles et porcines. Une fois qu’un virus saute sur un nouvel hôte, il peut se propager rapidement. Les scientifiques surveillent de près les virus nouvellement apparus (appelés virus émergents) dans l’espoir que cette surveillance puisse réduire la probabilité d’épidémies virales mondiales.
Les récepteurs de surface cellulaire sont impliqués dans la plupart des signaux des organismes multicellulaires. Il existe trois catégories générales de récepteurs de surface cellulaire : les récepteurs liés aux canaux ioniques, les récepteurs liés aux protéines G et les récepteurs liés aux enzymes.

Figure 2. Les canaux ioniques à grille forment un pore à travers la membrane plasmique qui s’ouvre lorsque la molécule de signalisation se lie. Le pore ouvert permet alors aux ions d’entrer ou de sortir de la cellule.
Les récepteurs liés aux canaux ioniques se lient à un ligand et ouvrent un canal à travers la membrane qui permet le passage d’ions spécifiques. Pour former un canal, ce type de récepteur de surface cellulaire possède une vaste région membranaire. Afin d’interagir avec les queues d’acides gras des phospholipides qui forment le centre de la membrane plasmique, de nombreux acides aminés de la région membranaire sont de nature hydrophobe. À l’inverse, les acides aminés qui tapissent l’intérieur du canal sont hydrophiles pour permettre le passage de l’eau ou des ions. Lorsqu’un ligand se lie à la région extracellulaire du canal, il se produit un changement de conformation dans la structure des protéines qui permet le passage d’ions tels que le sodium, le calcium, le magnésium et l’hydrogène (figure 2).
Les récepteurs liés aux protéines G se lient à un ligand et activent une protéine membranaire appelée protéine G. La protéine G activée interagit ensuite soit avec un canal ionique, soit avec une enzyme dans la membrane (figure 3). Tous les récepteurs liés à la protéine G possèdent sept domaines transmembranaires, mais chaque récepteur possède un domaine extracellulaire spécifique et un site de liaison à la protéine G.
La signalisation cellulaire à l’aide des récepteurs liés à la protéine G se produit comme une série cyclique d’événements. Avant que le ligand ne se lie, la protéine G inactive peut se lier à un site nouvellement révélé sur le récepteur spécifique à sa liaison. Une fois que la protéine G se lie au récepteur, le changement de forme qui en résulte active la protéine G, qui libère le PIB et capte le GTP. Les sous-unités de la protéine G se divisent alors en une sous-unité α et une sous-unité βγ. L’un ou l’autre de ces fragments de protéine G, ou les deux, peuvent ainsi activer d’autres protéines. Après un certain temps, le GTP sur la sous-unité α active de la protéine G est hydrolysé en GDP et la sous-unité βγ est désactivée. Les sous-unités se réassocient pour former la protéine G inactive et le cycle recommence.
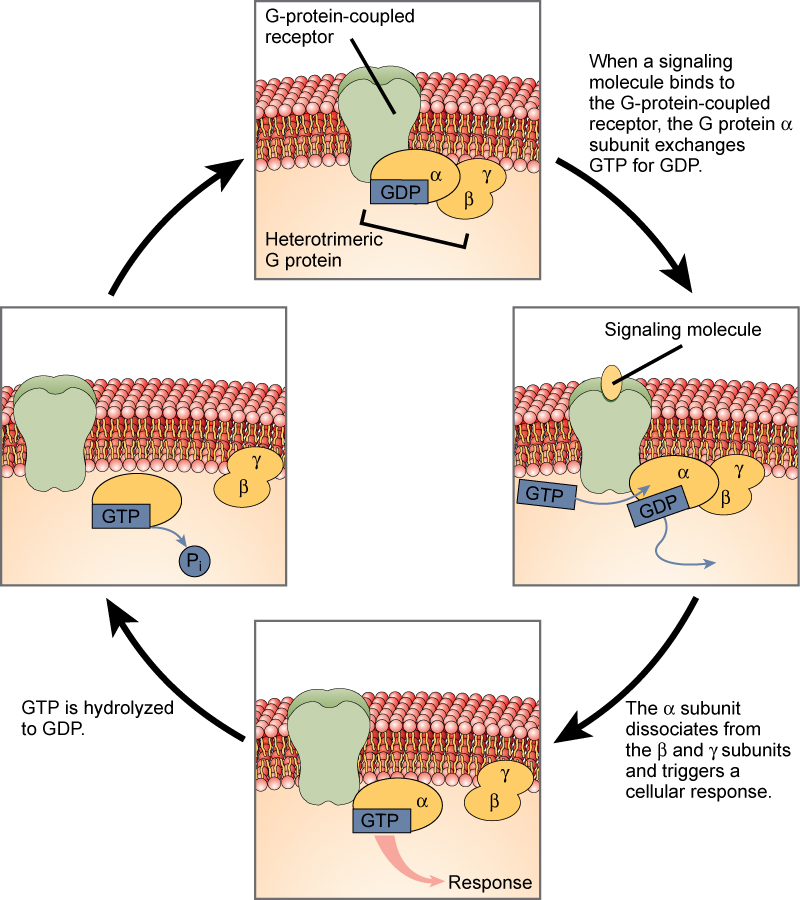
Figure 3. Les protéines G hétérotrimériques possèdent trois sous-unités : α, β et γ. Lorsqu’une molécule de signalisation se lie à un récepteur couplé à une protéine G dans la membrane plasmique, une molécule de PIB associée à la sous-unité α est échangée contre du GTP. Les sous-unités β et γ se dissocient de la sous-unité α, et une réponse cellulaire est déclenchée soit par la sous-unité α, soit par la paire βγ dissociée. L’hydrolyse du GTP en GDP met fin au signal.
Les récepteurs liés aux protéines G ont été largement étudiés et on a beaucoup appris sur leurs rôles dans le maintien de la santé. Les bactéries pathogènes pour l’homme peuvent libérer des poisons qui interrompent la fonction spécifique des récepteurs liés aux protéines G, entraînant des maladies telles que la coqueluche, le botulisme et le choléra.

Figure 4. Transmis principalement par l’eau potable contaminée, le choléra est une cause majeure de décès dans le monde en développement et dans les régions où les catastrophes naturelles interrompent la disponibilité de l’eau potable. (crédit : New York City Sanitary Commission)
Dans le cas du choléra (figure 4), par exemple, la bactérie Vibrio cholerae, transmise par l’eau, produit une toxine, le choléragène, qui se lie aux cellules qui tapissent l’intestin grêle. La toxine pénètre ensuite dans ces cellules intestinales, où elle modifie une protéine G qui contrôle l’ouverture d’un canal chlorure et fait en sorte qu’il reste continuellement actif, ce qui entraîne d’importantes pertes de fluides de l’organisme et une déshydratation potentiellement mortelle en conséquence.
L’assainissement moderne élimine la menace d’épidémies de choléra, comme celle qui a balayé la ville de New York en 1866. Cette affiche de l’époque montre comment, à l’époque, le mode de transmission de la maladie n’était pas compris.
Les récepteurs liés à une enzyme sont des récepteurs de surface cellulaire avec des domaines intracellulaires qui sont associés à une enzyme. Dans certains cas, le domaine intracellulaire du récepteur lui-même est une enzyme. D’autres récepteurs liés à une enzyme possèdent un petit domaine intracellulaire qui interagit directement avec une enzyme. Les récepteurs liés à une enzyme possèdent normalement de grands domaines extracellulaires et intracellulaires, mais la région membranaire est constituée d’une seule région alpha-hélicoïdale du brin peptidique. Lorsqu’un ligand se lie au domaine extracellulaire, un signal est transféré à travers la membrane, activant l’enzyme. L’activation de l’enzyme déclenche une chaîne d’événements à l’intérieur de la cellule qui conduit finalement à une réponse. Un exemple de ce type de récepteur lié à une enzyme est le récepteur de la tyrosine kinase (figure 5). Une kinase est une enzyme qui transfère les groupes phosphates de l’ATP à une autre protéine. Le récepteur de la tyrosine kinase transfère les groupes phosphates aux molécules de tyrosine (résidus de tyrosine). Tout d’abord, les molécules de signalisation se lient au domaine extracellulaire de deux récepteurs à tyrosine kinase voisins. Les deux récepteurs voisins se lient alors ensemble, ou se dimérisent. Des phosphates sont ensuite ajoutés aux résidus de tyrosine du domaine intracellulaire des récepteurs (phosphorylation). Les résidus phosphorylés peuvent alors transmettre le signal au messager suivant dans le cytoplasme.
Question d’entraînement

Figure 5. Un récepteur tyrosine kinase est un récepteur lié à une enzyme, avec une seule région transmembranaire, et des domaines extracellulaire et intracellulaire. La liaison d’une molécule de signalisation au domaine extracellulaire entraîne la dimérisation du récepteur. Les résidus de tyrosine du domaine intracellulaire sont alors autophosphorylés, ce qui déclenche une réponse cellulaire en aval. Le signal est terminé par une phosphatase qui élimine les phosphates des résidus de phosphotyrosine.
HER2 est un récepteur tyrosine kinase. Dans 30 % des cancers du sein humains, HER2 est activé en permanence, ce qui entraîne une division cellulaire non régulée. Le lapatinib, un médicament utilisé pour traiter le cancer du sein, inhibe l’autophosphorylation de la tyrosine kinase du récepteur HER2 (le processus par lequel le récepteur ajoute des phosphates sur lui-même), réduisant ainsi la croissance tumorale de 50 pour cent. Outre l’autophosphorylation, laquelle des étapes suivantes serait inhibée par le Lapatinib ?
- La liaison des molécules de signalisation, la dimérisation et la réponse cellulaire en aval
- Dimérisation, et la réponse cellulaire en aval
- La réponse cellulaire en aval
- L’activité phosphatase, la dimérisation, et la réponse cellulaire en aval
Try It
Contribuez !
Améliorer cette pageEn savoir plus