Les aminoglycosides présentent une activité bactéricide dépendante de la concentration contre « la plupart des bacilles aérobies gram-négatifs et anaérobies facultatifs » mais pas contre les anaérobies gram-négatifs et la plupart des bactéries gram-positives. Ils ne nécessitent qu’un court temps de contact, et sont plus efficaces contre les populations bactériennes sensibles qui se multiplient rapidement. Ces activités sont attribuées à un mode d’action primaire en tant qu’inhibiteurs de la synthèse protéique, bien que d’autres mécanismes soient impliqués pour certains agents spécifiques, et/ou que des descriptions mécanistiques approfondies ne soient pas encore disponibles.
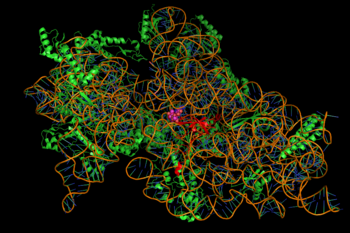
L’inhibition de la synthèse protéique est médiée par la liaison dépendant de l’énergie, parfois irréversible, des aminoglycosides au ribosome bactérien cytosolique, associé à la membrane (image à droite). (Les aminoglycosides traversent d’abord les parois cellulaires bactériennes – le lipopolysaccharide chez les bactéries gram-négatives – et les membranes cellulaires, où ils sont activement transportés). Bien que les étapes spécifiques de la synthèse protéique affectées puissent varier quelque peu d’un agent aminoglycoside à l’autre, tout comme leur affinité et leur degré de liaison, la présence d’un aminoglycoside dans le cytosol perturbe généralement l’élongation des peptides au niveau de la sous-unité ribosomique 30S, ce qui donne lieu à une traduction inexacte de l’ARNm et, par conséquent, à la biosynthèse de protéines tronquées ou portant des compositions d’acides aminés altérées à certains endroits. Plus précisément, la liaison nuit à la correction de la traduction, ce qui entraîne une mauvaise lecture du message de l’ARN, une terminaison prématurée, ou les deux, et donc une imprécision du produit protéique traduit. Le sous-ensemble de protéines aberrantes qui est incorporé dans la membrane de la cellule bactérienne peut ensuite entraîner des modifications de sa perméabilité et donc une « stimulation supplémentaire du transport des aminoglycosides ». La partie sucre aminé de cette classe de molécules (par exemple, la 2-désoxystreptamine dans les kanamycines, les gentamicines et la tobramycine, voir ci-dessus) est impliquée dans l’association de la petite molécule avec les structures ribosomales qui conduisent aux infidélités de la traduction (ibid.). L’inhibition de la translocation ribosomique, c’est-à-dire le déplacement du peptidyl-ARNt du site A au site P, a également été suggérée. Des expériences récentes de suivi de molécules uniques dans des E. coli vivants ont montré une synthèse protéique continue mais plus lente après traitement avec différents aminoglycosides. (La spectinomycine, une classe de structure chimique apparentée mais distincte souvent discutée avec les aminoglycosides, n’induit pas de mauvaise lecture de l’ARNm et n’est généralement pas bactéricide.)
Enfin, un autre « effet de membrane cellulaire » se produit également avec les aminoglycosides ; « l’intégrité fonctionnelle de la membrane cellulaire bactérienne » peut être perdue, plus tard dans les cours temporels de l’exposition et du transport des aminoglycosides.
Pharmacocinétique et pharmacodynamiqueModification
Il existe une variabilité importante dans la relation entre la dose administrée et le taux plasmatique sanguin qui en résulte. La surveillance thérapeutique des médicaments (TDM) est nécessaire pour obtenir la dose correcte. Ces agents présentent un effet post-antibiotique dans lequel le niveau de médicament détectable dans le sang est nul ou très faible, mais il semble toujours y avoir une inhibition de la recroissance bactérienne. Cet effet est dû à une liaison forte et irréversible au ribosome, et reste intracellulaire longtemps après la chute des taux plasmatiques, ce qui permet un intervalle posologique prolongé. Selon leur concentration, ils agissent comme des agents bactériostatiques ou bactéricides.
IndicationsEdit
Les aminoglycosides sont utiles principalement dans les infections impliquant des bactéries aérobies à Gram négatif, telles que Pseudomonas, Acinetobacter et Enterobacter. En outre, certaines mycobactéries, notamment les bactéries responsables de la tuberculose, sont sensibles aux aminoglycosides. La streptomycine a été le premier médicament efficace dans le traitement de la tuberculose, bien que le rôle des aminoglycosides tels que la streptomycine et l’amikacine ait été éclipsé (en raison de leur toxicité et de leur mode d’administration peu commode), sauf pour les souches multirésistantes. L’utilisation la plus fréquente des aminoglycosides est le traitement empirique des infections graves telles que la septicémie, les infections intra-abdominales compliquées, les infections urinaires compliquées et les infections nosocomiales des voies respiratoires. Habituellement, une fois que des cultures de l’organisme responsable sont réalisées et que leur sensibilité est testée, les aminoglycosides sont abandonnés au profit d’antibiotiques moins toxiques.
Comme indiqué, les aminoglycosides sont surtout inefficaces contre les bactéries anaérobies, les champignons et les virus. Les infections causées par les bactéries à Gram positif peuvent également être traitées par les aminoglycosides, mais d’autres types d’antibiotiques sont plus puissants et moins dommageables pour l’hôte. Dans le passé, les aminoglycosides ont été utilisés en association avec des bêta-lactamines dans les infections à streptocoques pour leurs effets synergiques, en particulier dans les endocardites. L’une des associations les plus fréquentes est l’ampicilline (une bêta-lactamine, ou antibiotique apparenté à la pénicilline) et la gentamicine. Souvent, le personnel hospitalier appelle cette association « amp et gent » ou plus récemment « pen et gent » pour pénicilline et gentamicine.
Suppression du non-sensModification
L’interférence avec la relecture de l’ARNm a été exploitée pour traiter les maladies génétiques qui résultent de codons stop prématurés (conduisant à une fin précoce de la synthèse des protéines et à des protéines tronquées). Les aminoglycosides peuvent amener la cellule à surmonter les codons stop, à insérer un acide aminé aléatoire et à exprimer une protéine complète. La gentamicine, un aminoglycoside, a été utilisée pour traiter les cellules de la fibrose kystique (FK) en laboratoire afin de les amener à produire des protéines complètes. La FK est causée par une mutation du gène codant pour la protéine CFTR (cystic fibrosis transmembrane conductance regulator). Dans environ 10 % des cas de FK, la mutation de ce gène entraîne sa terminaison précoce au cours de la traduction, ce qui conduit à la formation d’une protéine CFTR tronquée et non fonctionnelle. On pense que la gentamicine déforme la structure du complexe ribosome-ARN, entraînant une mauvaise lecture du codon de terminaison, ce qui fait que le ribosome « saute » la séquence d’arrêt et poursuit l’élongation et la production normales de la protéine CFTR.
.