Conductivité
Une autre propriété caractéristique des composés ioniques est leur conductivité électrique. La figure ci-dessous montre trois expériences dans lesquelles deux électrodes reliées à une ampoule sont placées dans des béchers contenant trois substances différentes.
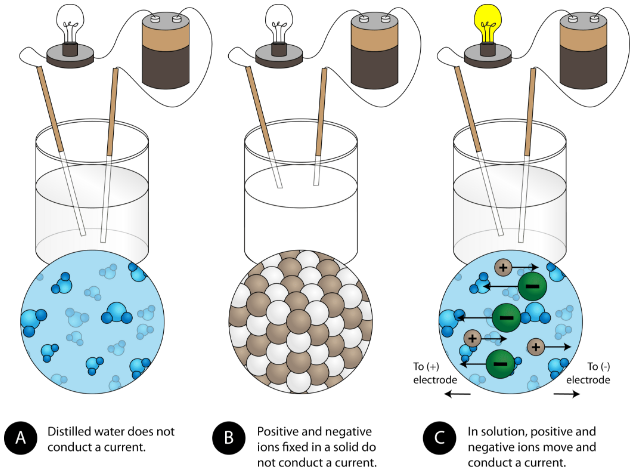
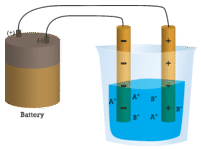
Dans le premier bécher, l’eau distillée ne conduit pas le courant car l’eau est un composé moléculaire. Dans le deuxième bécher, le chlorure de sodium solide ne conduit pas non plus de courant. Bien qu’il soit ionique et donc composé de particules chargées, le réseau cristallin solide ne permet pas aux ions de se déplacer entre les électrodes. Des particules chargées mobiles sont nécessaires pour que le circuit soit complet et que l’ampoule s’allume. Dans le troisième bécher, le NaCl a été dissous dans l’eau distillée. Maintenant, le réseau cristallin a été brisé et les ions positifs et négatifs individuels peuvent se déplacer. Les cations se déplacent vers une électrode, tandis que les anions se déplacent vers l’autre, permettant à l’électricité de circuler (voir la figure ci-dessous). La fusion d’un composé ionique libère également les ions pour qu’ils puissent conduire un courant. Les composés ioniques conduisent un courant électrique lorsqu’ils sont fondus ou dissous dans l’eau. La dissolution des composés ioniques dans l’eau sera abordée à la section 9.3.
Exemple \(\PageIndex{1}\)
Écrivez l’équation de dissociation du NaCl solide dans l’eau.
Solution
NaCl(s) → Na+(aq) + Cl-(aq)
Exercice \(\PageIndex{1}\)
Écrivez l’équation de dissociation de NH4NO3 solide dans l’eau.
Réponse
NH4NO3(s) → NH4+(aq) + NO3-(aq)
.