En términos simplistas, los anticuerpos realizan dos funciones principales en diferentes regiones de su estructura. Mientras que una parte del anticuerpo, el fragmento de unión al antígeno (Fab), reconoce al antígeno, la otra parte del anticuerpo, conocida como fragmento cristalizable (Fc), interactúa con otros elementos del sistema inmunitario, como los fagocitos o los componentes de la vía del complemento, para promover la eliminación del antígeno.
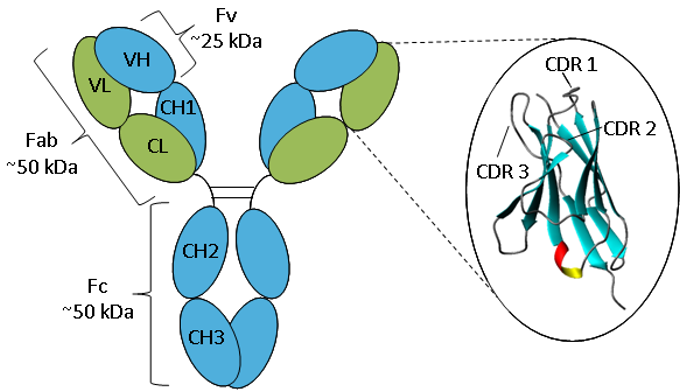
Figura. Representación esquemática de una IgG.
Un anticuerpo consta de dos cadenas pesadas (azul) y dos cadenas ligeras (verde) plegadas en dominios constantes y variables. La ampliación del dominio variable muestra una representación en forma de cinta de la estructura de la hoja β y los bucles CDR.
Todos los anticuerpos tienen la misma estructura básica que consiste en dos cadenas pesadas y dos ligeras que forman dos brazos Fab que contienen dominios idénticos en cada extremo unidos por una región de bisagra flexible al tallo del anticuerpo, el dominio Fc, dando la clásica forma de «Y». Las cadenas se pliegan en pliegues de inmunoglobulina repetidos que consisten en hojas β antiparalelas (1), que forman dominios constantes o variables. Los dominios Fab constan de dos dominios variables y dos constantes; los dos dominios variables constituyen el fragmento variable (Fv), que proporciona la especificidad antigénica del anticuerpo (2) y los dominios constantes actúan como marco estructural. Cada dominio variable contiene tres bucles hipervariables, conocidos como regiones determinantes de la complementariedad (CDR), distribuidos uniformemente entre cuatro regiones de estructura menos variable (FR). Son las CDR las que proporcionan un sitio específico de reconocimiento del antígeno en la superficie del anticuerpo y la hipervariabilidad de estas regiones permite a los anticuerpos reconocer un número casi ilimitado de antígenos (3).
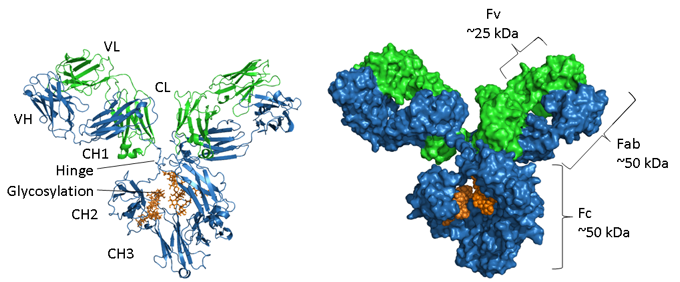
Figura. Representaciones estructurales de una IgG.
La cadena pesada se muestra en azul, la cadena ligera en verde y la glicosilación en naranja. A la izquierda hay una representación de cinta que muestra los elementos de la estructura secundaria y a la derecha hay un modelo relleno de espacio de la misma molécula. El número de acceso al PDB de la IgG1 de ratón es 1IGY.
Los anticuerpos son proteínas glicosiladas, y la posición y el grado de glicosilación varían entre los isotipos. Como se muestra en la imagen de arriba, la región Fc de una IgG consta de dos dominios CH3 emparejados y, en cambio, dos dominios CH2 que están separados y no interactúan, pero tienen dos cadenas de oligosacáridos interpuestas entre ellos. Estas cadenas cubren las caras hidrofóbicas que normalmente conducirían al emparejamiento de los dominios. Los N-glicanos contienen una región central común de dos residuos de N-acetil-glucosamina (GlcNAc) unidos a una asparagina (N297 en la IgG1 humana) mediante un enlace amida y tres residuos de manosa. Esta estructura central puede contener azúcares terminales adicionales, como manosa, GlcNac, galactosa, fucosa y ácido siálico, generando una gran heterogeneidad (4).
<< Una breve historia de los anticuerpos Isotipos de anticuerpos & subtipos >>
<< Resumen de anticuerpos >>
- Poljak, R.J., Amzel, L.M., Avey, H.P., Chen, B.L., Phizackerley, R.P., y Saul, F. (1973). Three-dimensional structure of the Fab’ fragment of a human immunoglobulin at 2,8-A resolution. Proc. Natl. Acad. Sci. U.S.A. 70, 3305-3310.
- Inbar, D., Hochman, J., y Givol, D. (1972). Localización de sitios de combinación de anticuerpos dentro de las porciones variables de las cadenas pesadas y ligeras. Proc. Natl. Acad. Sci. U.S.A. 69, 2659-2662.
- Morea, V., Lesk, A.M., y Tramontano, A. (2000). Modelización de anticuerpos: implicaciones para la ingeniería y el diseño. Methods 20, 267-279.
- Wright, A., y Morrison, S.L. (1998). Effect of C2-associated carbohydrate structure on Ig effector function: studies with chimeric mouse-human IgG1 antibodies in glycosylation mutants of Chinese hamster ovary cells. J. Immunol. 160, 3393-3402.
- Por lo tanto, es necesario que los anticuerpos se encuentren en una fase de desarrollo.