Definida estrictamente, la ionización es la pérdida completa de un electrón de una especie atómica o molecular.La especie resultante se llama ion.

En las ecuaciones químicas, la carga de los iones se muestra como un superíndice, como en esta sencilla reacción de ionización:
Los iones pueden ionizarse más:
Los iones con carga positiva suelen denominarse cationes.
Aunque en términos estrictos la ionización se refiere a la formación de un ion positivo, en el uso normal, la palabra también incluye la formación de un ion negativo:
Los iones con carga negativa suelen denominarse aniones.
Ionización directa de elementos
Los metales suelen formar cationes y los no metales suelen formar aniones.Algunos elementos, como el carbono, el oro y los gases nobles, no forman iones fácilmente.
Los metales alcalinos del grupo 1 de la tabla periódica y los haluros del grupo 17 se ionizan con mucha facilidad.Los metales alcalinos sólo necesitan perder un electrón para obtener una envoltura electrónica completa: del mismo modo, los haluros sólo necesitan ganar un electrón para conseguirlo.Por ejemplo, el sodio y el cloro reaccionan espontáneamente ionizándose para formar el compuesto iónico cloruro de sodio:
El potasio y el agua reaccionan ionizándose para producir el compuesto iónico hidróxido de potasio más hidrógeno:
Ionización de moléculas en solución
Las moléculas de gas de cloruro de hidrógeno se ionizan fácilmente en el agua para producir ácido clorhídrico.
Autoionización
En el agua, existe un equilibrio entre las moléculas de agua y los iones resultantes de la autoionización del agua. (Ver anfiprótico.)
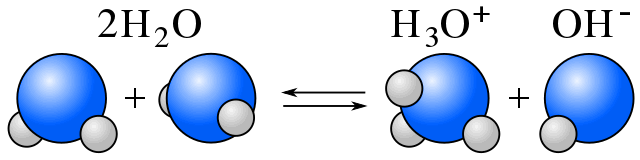
Ionización en el plasma
A temperaturas muy altas, los electrones se desprenden de los átomos para formar un plasma.Por ejemplo, en la corona solar:
La energía necesaria para eliminar un electrón de una especie es su energía de ionización.La energía para eliminar un segundo electrón es la segunda energía de ionización; para eliminar un tercero es la tercera energía de ionización, etc.
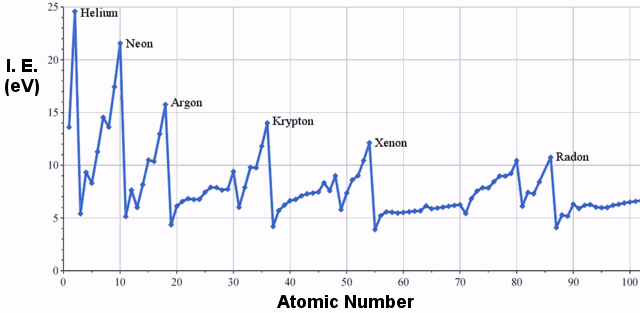
Ejemplos de energía de ionización
Las primeras energías de ionización de los elementos de la tercera fila de la tabla periódica son las siguientes:
Primera energía de ionización
| Elemento | Energía de primera ionización (eV) | ||
|---|---|---|---|
| Sodio | 5.14 | ||
| Magnesio | 7,65 | ||
| Aluminio | 5,99 | ||
| Silicio | 8.15 | ||
| Fósforo | 10,49 | ||
| Azufre | 10,36 | ||
| Cloro | 12,97 | Argón | 15.76 |
Claramente, hay una tendencia de aumento de la energía de ionización moviéndose de izquierda a derecha en la tabla periódica.El siguiente gráfico ilustra esta tendencia para una selección más amplia de elementos: