Resultados de aprendizaje
- Identificar los tipos de receptores, su composición molecular y las diferencias entre ellos
Los receptores son moléculas proteicas en la célula diana o en su superficie que se unen al ligando. Existen dos tipos de receptores, los receptores internos y los receptores de la superficie celular.
Receptores internos

Figura 1. Las moléculas señalizadoras hidrofóbicas suelen difundirse a través de la membrana plasmática e interactuar con los receptores intracelulares en el citoplasma. Muchos receptores intracelulares son factores de transcripción que interactúan con el ADN en el núcleo y regulan la expresión de los genes.
Los receptores internos, también conocidos como receptores intracelulares o citoplásmicos, se encuentran en el citoplasma de la célula y responden a moléculas ligando hidrofóbicas que son capaces de viajar a través de la membrana plasmática. Una vez dentro de la célula, muchas de estas moléculas se unen a proteínas que actúan como reguladores de la síntesis de ARNm (transcripción) para mediar en la expresión de los genes. La expresión génica es el proceso celular de transformación de la información del ADN de una célula en una secuencia de aminoácidos, que finalmente forma una proteína. Cuando el ligando se une al receptor interno, se desencadena un cambio conformacional que expone un sitio de unión al ADN en la proteína. El complejo ligando-receptor se traslada al núcleo, se une a regiones reguladoras específicas del ADN cromosómico y promueve el inicio de la transcripción (Figura 1). La transcripción es el proceso de copiar la información del ADN de una célula en una forma especial de ARN llamada ARN mensajero (ARNm); la célula utiliza la información del ARNm (que se desplaza al citoplasma y se asocia con los ribosomas) para unir aminoácidos específicos en el orden correcto, produciendo una proteína. Los receptores internos pueden influir directamente en la expresión de los genes sin tener que pasar la señal a otros receptores o mensajeros.
Receptores de la superficie celular
Los receptores de la superficie celular, también conocidos como receptores transmembrana, son proteínas de la superficie celular ancladas a la membrana (integrales) que se unen a moléculas de ligando externas. Este tipo de receptor se extiende por la membrana plasmática y realiza la transducción de señales, en la que una señal extracelular se convierte en una señal intercelular. Los ligandos que interactúan con los receptores de la superficie celular no tienen que entrar en la célula a la que afectan. Los receptores de la superficie celular también se denominan proteínas específicas de la célula o marcadores porque son específicos de cada tipo de célula.
Cada receptor de la superficie celular tiene tres componentes principales: un dominio externo de unión al ligando, una región hidrofóbica que se extiende por la membrana y un dominio intracelular dentro de la célula. El dominio de unión al ligando también se denomina dominio extracelular. El tamaño y la extensión de cada uno de estos dominios varían mucho, dependiendo del tipo de receptor.
Dado que las proteínas receptoras de la superficie celular son fundamentales para el funcionamiento normal de la célula, no debe sorprender que un mal funcionamiento en cualquiera de estas proteínas pueda tener graves consecuencias. Se ha demostrado que los errores en las estructuras proteicas de ciertas moléculas receptoras desempeñan un papel en la hipertensión (presión arterial alta), el asma, las enfermedades cardíacas y el cáncer.
Cómo reconocen los virus a un huésped
A diferencia de las células vivas, muchos virus no tienen una membrana plasmática ni ninguna de las estructuras necesarias para mantener la vida. Algunos virus se componen simplemente de una cubierta proteica inerte que contiene ADN o ARN. Para reproducirse, los virus deben invadir una célula viva, que les sirve de huésped, y luego tomar el control del aparato celular del huésped. Pero, ¿cómo reconoce un virus a su huésped?
Los virus suelen unirse a los receptores de la superficie celular de la célula huésped. Por ejemplo, el virus que causa la gripe humana se une específicamente a los receptores de las membranas de las células del sistema respiratorio. Las diferencias químicas en los receptores de la superficie celular entre los huéspedes hacen que un virus que infecta a una especie específica (por ejemplo, los seres humanos) no pueda infectar a otra especie (por ejemplo, los pollos).
Sin embargo, los virus tienen cantidades muy pequeñas de ADN o ARN en comparación con los seres humanos y, como resultado, la reproducción viral puede ocurrir rápidamente. La reproducción viral produce invariablemente errores que pueden dar lugar a cambios en los virus recién producidos; estos cambios significan que las proteínas virales que interactúan con los receptores de la superficie celular pueden evolucionar de manera que puedan unirse a los receptores de un nuevo huésped. Estos cambios ocurren al azar y con bastante frecuencia en el ciclo reproductivo de un virus, pero los cambios sólo importan si un virus con nuevas propiedades de unión entra en contacto con un huésped adecuado. En el caso de la gripe, esta situación puede darse en entornos en los que los animales y las personas están en estrecho contacto, como las granjas avícolas y porcinas. Una vez que un virus salta a un nuevo huésped, puede propagarse rápidamente. Los científicos vigilan de cerca los virus que acaban de aparecer (denominados virus emergentes) con la esperanza de que este seguimiento pueda reducir la probabilidad de que se produzcan epidemias víricas a nivel mundial.
Los receptores de la superficie de las células participan en la mayor parte de la señalización de los organismos multicelulares. Hay tres categorías generales de receptores de la superficie celular: receptores vinculados a canales iónicos, receptores vinculados a proteínas G y receptores vinculados a enzimas.

Figura 2. Los canales iónicos con compuerta forman un poro a través de la membrana plasmática que se abre cuando la molécula de señalización se une. El poro abierto permite entonces que los iones fluyan dentro o fuera de la célula.
Los receptores ligados a canales iónicos se unen a un ligando y abren un canal a través de la membrana que permite el paso de iones específicos. Para formar un canal, este tipo de receptor de la superficie celular tiene una extensa región que abarca la membrana. Para poder interactuar con las colas de ácidos grasos de los fosfolípidos que forman el centro de la membrana plasmática, muchos de los aminoácidos de la región que abarca la membrana son de naturaleza hidrofóbica. Por el contrario, los aminoácidos que recubren el interior del canal son hidrofílicos para permitir el paso del agua o de los iones. Cuando un ligando se une a la región extracelular del canal, se produce un cambio conformacional en la estructura de las proteínas que permite el paso de iones como el sodio, el calcio, el magnesio y el hidrógeno (Figura 2).
Los receptores vinculados a la proteína G se unen a un ligando y activan una proteína de membrana llamada proteína G. La proteína G activada interactúa entonces con un canal iónico o una enzima de la membrana (Figura 3). Todos los receptores ligados a la proteína G tienen siete dominios transmembrana, pero cada receptor tiene su propio dominio extracelular específico y su sitio de unión a la proteína G.
La señalización celular mediante los receptores ligados a la proteína G se produce como una serie cíclica de acontecimientos. Antes de que el ligando se una, la proteína G inactiva puede unirse a un sitio recién revelado en el receptor específico para su unión. Una vez que la proteína G se une al receptor, el cambio de forma resultante activa la proteína G, que libera el GDP y recoge el GTP. Las subunidades de la proteína G se dividen entonces en la subunidad α y la subunidad βγ. Uno de estos fragmentos de la proteína G, o ambos, pueden activar otras proteínas como resultado. Después de un tiempo, el GTP de la subunidad α activa de la proteína G se hidroliza a GDP y la subunidad βγ se desactiva. Las subunidades se reasocian para formar la proteína G inactiva y el ciclo comienza de nuevo.
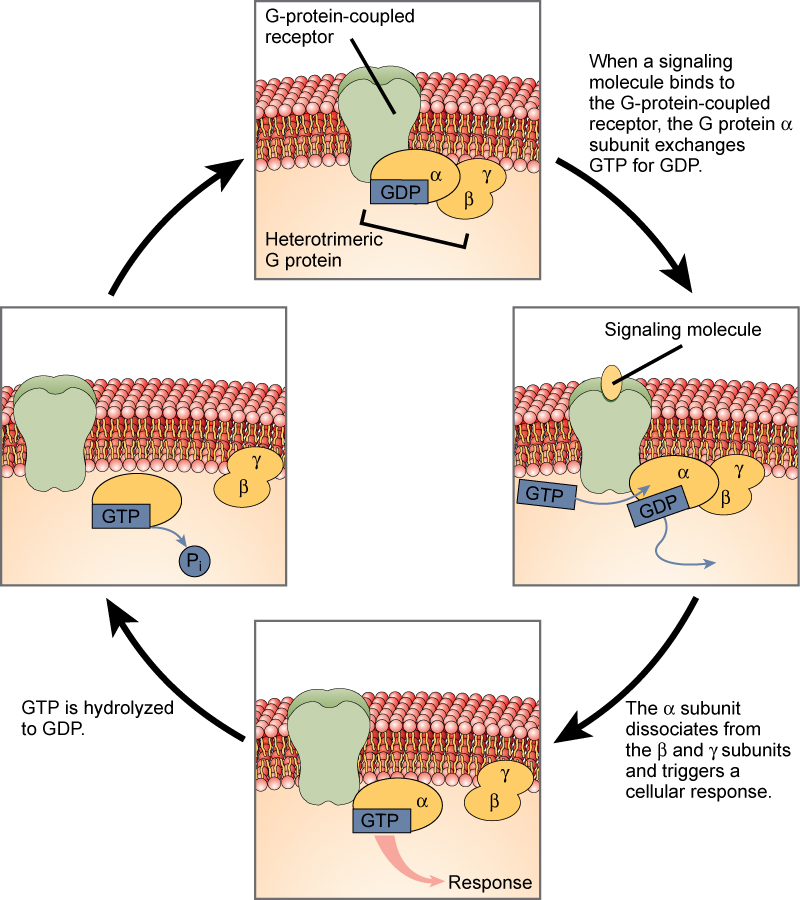
Figura 3. Las proteínas G heterotriméricas tienen tres subunidades: α, β y γ. Cuando una molécula de señalización se une a un receptor acoplado a la proteína G en la membrana plasmática, una molécula de GDP asociada a la subunidad α se intercambia por GTP. Las subunidades β y γ se disocian de la subunidad α, y se desencadena una respuesta celular, ya sea por la subunidad α o por el par βγ disociado. La hidrólisis de GTP a GDP termina la señal.
Los receptores ligados a la proteína G han sido ampliamente estudiados y se ha aprendido mucho sobre sus funciones en el mantenimiento de la salud. Las bacterias patógenas para el ser humano pueden liberar venenos que interrumpen la función específica de los receptores ligados a la proteína G, lo que provoca enfermedades como la tos ferina, el botulismo y el cólera.

Figura 4. El cólera, que se transmite principalmente a través del agua potable contaminada, es una de las principales causas de muerte en el mundo en desarrollo y en las zonas donde los desastres naturales interrumpen la disponibilidad de agua potable. (Crédito: Comisión Sanitaria de la Ciudad de Nueva York)
En el cólera (Figura 4), por ejemplo, la bacteria Vibrio cholerae, que se transmite por el agua, produce una toxina, el colerágeno, que se une a las células que recubren el intestino delgado. La toxina entra entonces en estas células intestinales, donde modifica una proteína G que controla la apertura de un canal de cloruro y hace que permanezca continuamente activa, lo que provoca grandes pérdidas de líquidos del cuerpo y, como resultado, una deshidratación potencialmente mortal.
El saneamiento moderno elimina la amenaza de brotes de cólera, como el que arrasó la ciudad de Nueva York en 1866. Este póster de la época muestra cómo, en aquel momento, no se comprendía la forma en que se transmitía la enfermedad.
Los receptores ligados a enzimas son receptores de la superficie celular con dominios intracelulares que se asocian a una enzima. En algunos casos, el propio dominio intracelular del receptor es una enzima. Otros receptores ligados a enzimas tienen un pequeño dominio intracelular que interactúa directamente con una enzima. Los receptores ligados a enzimas tienen normalmente grandes dominios extracelulares e intracelulares, pero la región que abarca la membrana consiste en una única región alfa-hélica de la cadena peptídica. Cuando un ligando se une al dominio extracelular, se transfiere una señal a través de la membrana, activando la enzima. La activación de la enzima desencadena una cadena de acontecimientos dentro de la célula que acaba provocando una respuesta. Un ejemplo de este tipo de receptor ligado a una enzima es el receptor de la tirosina quinasa (Figura 5). Una quinasa es una enzima que transfiere grupos fosfato del ATP a otra proteína. El receptor de tirosina quinasa transfiere grupos fosfato a moléculas de tirosina (residuos de tirosina). En primer lugar, las moléculas de señalización se unen al dominio extracelular de dos receptores de tirosina quinasa cercanos. A continuación, los dos receptores vecinos se unen, o dimerizan. A continuación, se añaden fosfatos a los residuos de tirosina del dominio intracelular de los receptores (fosforilación). Los residuos fosforilados pueden entonces transmitir la señal al siguiente mensajero dentro del citoplasma.
Pregunta de práctica

Figura 5. Un receptor tirosina quinasa es un receptor ligado a una enzima con una única región transmembrana y dominios extracelulares e intracelulares. La unión de una molécula de señalización al dominio extracelular hace que el receptor se dimerice. Los residuos de tirosina del dominio intracelular se autofosforilan, desencadenando una respuesta celular posterior. La señal es terminada por una fosfatasa que elimina los fosfatos de los residuos de fosfotirosina.
HER2 es un receptor tirosina quinasa. En el 30 por ciento de los cánceres de mama humanos, el HER2 está permanentemente activado, lo que da lugar a una división celular no regulada. El lapatinib, un fármaco utilizado para tratar el cáncer de mama, inhibe la autofosforilación de la tirosina quinasa del receptor HER2 (el proceso por el que el receptor añade fosfatos sobre sí mismo), reduciendo así el crecimiento del tumor en un 50 por ciento. Además de la autofosforilación, ¿cuál de los siguientes pasos sería inhibido por Lapatinib?
- Unión de la molécula de señalización, dimerización y la respuesta celular descendente
- Dimerización, y la respuesta celular descendente
- La respuesta celular descendente
- Actividad de la fosfatasa, dimerización, y la respuesta celular descendente
¡Contribuye!
Mejora esta páginaAprende más