Los aminoglucósidos muestran una actividad bactericida dependiente de la concentración contra «la mayoría de los bacilos aerobios y anaerobios facultativos» pero no contra los anaerobios gramnegativos y la mayoría de las bacterias grampositivas. Sólo requieren un breve tiempo de contacto y son más eficaces contra las poblaciones bacterianas susceptibles que se multiplican rápidamente. Estas actividades se atribuyen a un modo de acción primario como inhibidores de la síntesis de proteínas, aunque hay mecanismos adicionales implicados para algunos agentes específicos, y/o todavía no se dispone de descripciones mecanísticas completas.
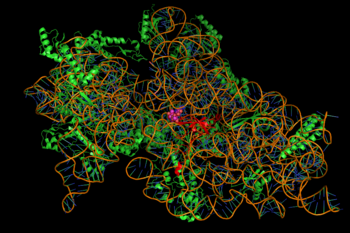
La inhibición de la síntesis de proteínas está mediada por la unión de los aminoglucósidos, dependiente de la energía y a veces irreversible, al ribosoma bacteriano citosólico asociado a la membrana (imagen de la derecha). (Los aminoglucósidos atraviesan primero las paredes celulares bacterianas -lipopolisacáridos en las bacterias gramnegativas- y las membranas celulares, donde son transportados activamente). Aunque los pasos específicos de la síntesis de proteínas afectados pueden variar un poco entre los agentes aminoglucósidos específicos, al igual que su afinidad y grado de unión, la presencia de aminoglucósidos en el citosol generalmente perturba la elongación de los péptidos en la subunidad ribosomal 30S, dando lugar a una traducción inexacta del ARNm y, por tanto, a la biosíntesis de proteínas truncadas o con composiciones de aminoácidos alteradas en puntos concretos. Específicamente, la unión perjudica la corrección de la traducción, lo que lleva a una lectura errónea del mensaje de ARN, a una terminación prematura, o a ambas cosas, y por tanto a una inexactitud del producto proteico traducido. El subconjunto de proteínas aberrantes que se incorporan a la membrana de la célula bacteriana puede provocar entonces cambios en su permeabilidad y, por tanto, una «mayor estimulación del transporte de aminoglucósidos». La porción de aminoazúcar de esta clase de moléculas (por ejemplo, la 2-deoxistroptamina en las kanamicinas, gentamicinas y tobramicina, véase más arriba) está implicada en la asociación de la pequeña molécula con las estructuras ribosómicas que conducen a las infidelidades en la traducción (ibíd.). También se ha sugerido la inhibición de la translocación ribosomal, es decir, el movimiento del peptidil-ARNt desde el sitio A al P. Recientes experimentos de rastreo de una sola molécula en E. coli viva mostraron una síntesis proteica continua pero más lenta tras el tratamiento con diferentes fármacos aminoglucósidos. (La espectinomicina, una clase de estructura química relacionada pero distinta que a menudo se discute con los aminoglucósidos, no induce una lectura errónea del ARNm y, por lo general, no es bactericida.)
Por último, también se produce un «efecto de membrana celular» adicional con los aminoglucósidos; puede perderse la «integridad funcional de la membrana celular bacteriana», más adelante en los cursos de tiempo de exposición y transporte de aminoglucósidos.
Farmacocinética y farmacodinámicaEditar
Hay una variabilidad significativa en la relación entre la dosis administrada y el nivel plasmático resultante en sangre. La monitorización terapéutica del fármaco (TDM) es necesaria para obtener la dosis correcta. Estos agentes presentan un efecto post-antibiótico en el que no hay ningún nivel de fármaco detectable en sangre, o muy poco, pero parece que sigue habiendo una inhibición del recrecimiento bacteriano. Esto se debe a una unión fuerte e irreversible al ribosoma, y permanece intracelular mucho tiempo después de que los niveles plasmáticos desciendan, y permite un intervalo de dosificación prolongado. Dependiendo de su concentración, actúan como agentes bacteriostáticos o bactericidas.
IndicacionesEditar
Los aminoglucósidos son útiles principalmente en las infecciones que implican a bacterias aerobias, Gram negativas, como Pseudomonas, Acinetobacter y Enterobacter. Además, algunas micobacterias, incluidas las que causan la tuberculosis, son sensibles a los aminoglucósidos. La estreptomicina fue el primer fármaco eficaz en el tratamiento de la tuberculosis, aunque el papel de los aminoglucósidos, como la estreptomicina y la amikacina, ha quedado eclipsado (por su toxicidad y su inconveniente vía de administración), salvo en el caso de las cepas multirresistentes. El uso más frecuente de los aminoglucósidos es el tratamiento empírico de infecciones graves como la sepsis, las infecciones intraabdominales complicadas, las infecciones urinarias complicadas y las infecciones nosocomiales del tracto respiratorio. Por lo general, una vez que se realizan cultivos del organismo causante y se comprueba su sensibilidad, se suspenden los aminoglucósidos en favor de antibióticos menos tóxicos.
Como se ha señalado, los aminoglucósidos son en su mayoría ineficaces contra las bacterias anaerobias, los hongos y los virus. Las infecciones causadas por bacterias Gram-positivas también pueden tratarse con aminoglucósidos, pero otros tipos de antibióticos son más potentes y menos dañinos para el huésped. En el pasado, los aminoglucósidos se han utilizado junto con los antibióticos betalactámicos en las infecciones estreptocócicas por sus efectos sinérgicos, en particular en la endocarditis. Una de las combinaciones más frecuentes es la de ampicilina (un antibiótico betalactámico, o relacionado con la penicilina) y gentamicina. A menudo, el personal de los hospitales se refiere a esta combinación como «amp y gent» o, más recientemente, como «pen y gent» para referirse a la penicilina y la gentamicina.
Supresión del sinsentidoEditar
La interferencia con la corrección del ARNm se ha explotado para tratar enfermedades genéticas que resultan de codones de parada prematuros (que conducen a la terminación temprana de la síntesis de proteínas y a proteínas truncadas). Los aminoglucósidos pueden hacer que la célula supere los codones de parada, inserte un aminoácido al azar y exprese una proteína de longitud completa. El aminoglucósido gentamicina se ha utilizado para tratar células de fibrosis quística (FQ) en el laboratorio para inducirlas a producir proteínas de longitud completa. La FQ está causada por una mutación en el gen que codifica la proteína reguladora de la conductancia transmembrana de la fibrosis quística (CFTR). En aproximadamente el 10% de los casos de FQ, la mutación en este gen provoca su terminación temprana durante la traducción, lo que lleva a la formación de una proteína CFTR truncada y no funcional. Se cree que la gentamicina distorsiona la estructura del complejo ribosoma-ARN, lo que conduce a una lectura errónea del codón de terminación, haciendo que el ribosoma se «salte» la secuencia de parada y continúe con la elongación y producción normal de la proteína CFTR.