Conductividad
Otra propiedad característica de los compuestos iónicos es su conductividad eléctrica. La figura siguiente muestra tres experimentos en los que dos electrodos que están conectados a una bombilla se colocan en vasos de precipitados que contienen tres sustancias diferentes.
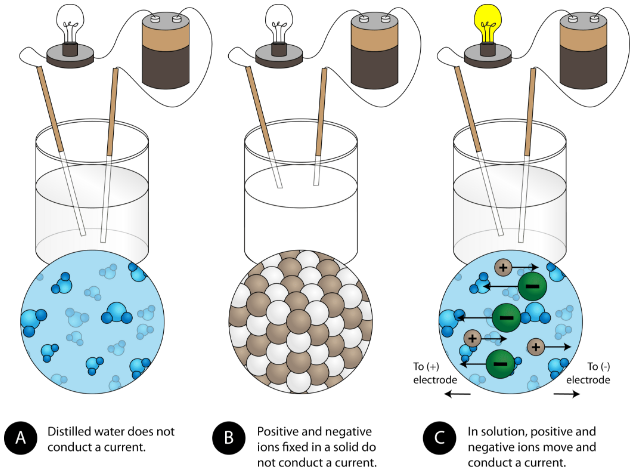
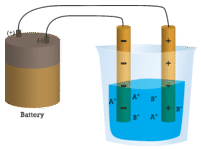
En el primer vaso, el agua destilada no conduce la corriente porque el agua es un compuesto molecular. En el segundo vaso, el cloruro de sodio sólido tampoco conduce la corriente. A pesar de ser iónico y, por tanto, estar compuesto por partículas cargadas, la red cristalina sólida no permite que los iones se muevan entre los electrodos. Las partículas cargadas móviles son necesarias para que el circuito se complete y la bombilla se encienda. En el tercer vaso de precipitados, el NaCl se ha disuelto en el agua destilada. Ahora la red cristalina se ha roto y los iones positivos y negativos individuales pueden moverse. Los cationes se mueven hacia un electrodo, mientras que los aniones se mueven hacia el otro, permitiendo que fluya la electricidad (véase la figura siguiente). Al fundir un compuesto iónico también se liberan los iones para conducir una corriente. Los compuestos iónicos conducen una corriente eléctrica cuando se funden o disuelven en agua. La disolución de los compuestos iónicos en agua se tratará en la sección 9.3.
Ejemplo (\PageIndex{1})
Escribe la ecuación de disociación del NaCl sólido en agua.
Solución
NaCl(s) → Na+(aq) + Cl-(aq)
Ejemplo (\PageIndex{1})
Escribe la ecuación de disociación del NH4NO3 sólido en agua.
Respuesta
NH4NO3(s) → NH4+(aq) + NO3-(aq)