Streng definiert ist Ionisation der vollständige Verlust eines Elektrons aus einer atomaren oder molekularen Spezies. Die resultierende Spezies wird als Ion bezeichnet.

In chemischen Gleichungen wird die Ladung von Ionen hochgestellt, wie zum Beispiel in dieser einfachen Ionisationsreaktion:
Ionen können weiter ionisieren:
Positiv geladene Ionen werden oft als Kationen bezeichnet.
Obwohl sich die Ionisation streng genommen auf die Bildung eines positiven Ions bezieht, schließt das Wort im normalen Sprachgebrauch auch die Bildung eines negativen Ions ein:
Negativ geladene Ionen werden oft als Anionen bezeichnet.
Direkte Ionisierung von Elementen
Metalle bilden typischerweise Kationen und Nichtmetalle bilden typischerweise Anionen.
Einige Elemente, wie Kohlenstoff, Gold und die Edelgase, bilden nicht ohne weiteres Ionen.
Die Alkalimetalle in Gruppe 1 des Periodensystems und die Halogenide in Gruppe 17 ionisieren sehr leicht.
Alkalimetalle müssen nur ein Elektron verlieren, um eine volle Elektronenschale zu erhalten; ebenso müssen Halogenide nur ein Elektron gewinnen, um dies zu erreichen.So reagieren z. B. Natrium und Chlor spontan durch Ionisation zu der Ionenverbindung Natriumchlorid:
Kalium und Wasser reagieren durch Ionisation zu der Ionenverbindung Kaliumhydroxid plus Wasserstoff:
Ionisierung von Molekülen in Lösung
Gasmoleküle des Chlorwasserstoffs ionisieren leicht in Wasser und erzeugen Salzsäure.
Selbstionisierung
In Wasser besteht ein Gleichgewicht zwischen Wassermolekülen und Ionen, die durch die Selbstionisierung des Wassers entstehen. (Siehe Amphiprotik.)
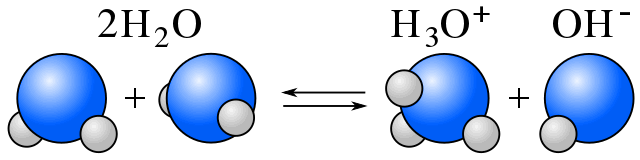
Ionisation im Plasma
Bei sehr hohen Temperaturen werden Elektronen aus den Atomen herausgelöst und bilden ein Plasma.Zum Beispiel in der Korona der Sonne:
Die Energie, die benötigt wird, um ein Elektron aus einer Spezies zu entfernen, ist die Ionisierungsenergie.
Die Energie, die benötigt wird, um ein zweites Elektron zu entfernen, ist die zweite Ionisierungsenergie; um ein drittes zu entfernen, ist die dritte Ionisierungsenergie, usw.
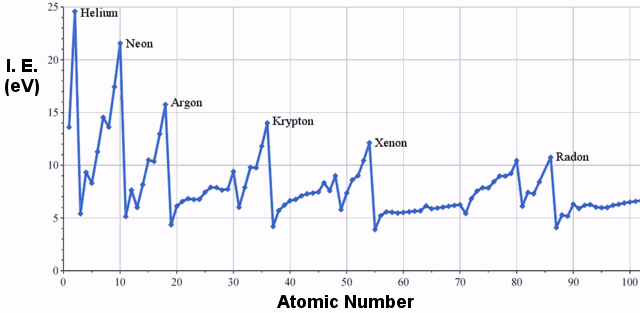
Beispiele für Ionisierungsenergie
Die ersten Ionisierungsenergien der Elemente in der dritten Reihe des Periodensystems sind wie folgt:
Erste Ionisierungsenergie
| Element | Erste Ionisierungsenergie (eV) |
|---|---|
| Natrium | 5.14 |
| Magnesium | 7,65 |
| Aluminium | 5,99 |
| Silizium | 8.15 |
| Phosphor | 10.49 |
| Schwefel | 10.36 |
| Chlor | 12.97 |
| Argon | 15.76 |
Es gibt eindeutig einen Trend zu steigender Ionisierungsenergie von links nach rechts im Periodensystem.Die folgende Grafik zeigt diesen Trend für eine größere Auswahl von Elementen: